Aqui o leitor encontrará informações sobre o halo, os elementos químicos da tabela periódica D. I. Mendeleeva. O conteúdo do artigo permitirá que você se familiarizar com as suas propriedades químicas e físicas, estar na natureza, os métodos de aplicação e outros.
informações gerais
Halogéneos – todos os elementos da química da tabela periódica que são no grupo XVII. De acordo com um método para classificar o estroma são todos os elementos do sétimo grupo, os principais subgrupos.
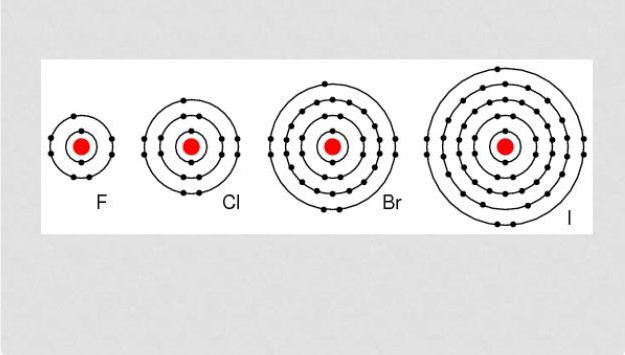
Halogênio – são elementos capazes de reagir com quase todas as substâncias tipo simples, exceto uma certa quantidade de não-metais. Todos estes são oxidantes de energia, porque, nas condições da natureza, tendem a ser de uma forma misturada com outras substâncias. halogéneos indicadoras reactividade diminui com o aumento da sua numeração ordinal.
Halogéneos seguintes elementos são os seguintes: flúor, cloro, bromo, iodo, astatine e tennesin criado artificialmente.
Como mencionado anteriormente, todos os halogéneos – é oxidante com propriedades distintas, além de todos eles são não-metais. External nível de energia tem sete elétrons. Interacção com metais conduz à formação de uma ligação iónica e sais. Quase todos os halogenetos excepto fluoreto, pode manifestar-se como um agente de redução, o grau de oxidação culminando 7, mas este requer que eles interagem com os elementos que tem um maior grau de electronegatividade.
características etimologia

Em 1841, o químico sueco J. Berzelius proposto a introdução do termo halogéneo, referindo-se a elas conhecido no momento, F, Br, I. No entanto, até à introdução do termo em relação a todo o grupo de elementos, em 1811, cientista alemão e . Shveygger mesma palavra chamada prazo cloro-se traduzido do grego como "solerod".
estrutura atómica e o grau de oxidação
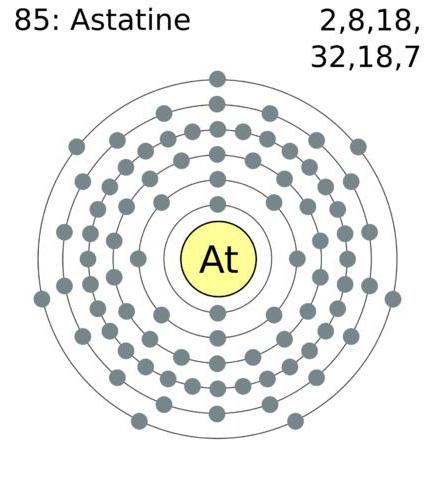
A configuração do invólucro externo de electrões de halogéneo atómica é: astatine – 6s 2 6p 5 iodo – 5s 5p 2 5 2 4p 4s bromo-5 cloro – 3s 3p 5 2, 2s fluoro dois 2p 5.
Halogênio – os elementos a ter sobre externa de elétrons tipo concha sete elétrons que lhes permite "sem esforço" anexar escudo do elétron que é insuficiente para completo. Tipicamente, o grau de oxidação é manifestada como -1. Cl, Br, I e A reacção com os elementos que tem um grau mais elevado, começam a mostrar um grau de oxidação positivo 1, 3, 5 e 7. O flúor tem um grau constante de -1 oxidativo.
propagação
Devido ao seu elevado grau de reactividade de halogéneos são geralmente sob a forma de compostos. Prevalência na crosta terrestre diminui de acordo com o aumento do raio atómico de F a I. Astatine na crosta terrestre em tudo medido em gramas e tennessin criados artificialmente.
Halogenetos são encontrados na natureza o mais frequentemente em compostos de halogenetos, e iodo pode igualmente assumir a forma de iodato de potássio ou de sódio. Devido à sua solubilidade em água presente nas águas do mar e salmouras de origem natural. O F – moderadamente representante de halogénio e mais frequentemente encontrada nas rochas de tipo sedimentar, e a sua fonte principal – um fluoreto de cálcio.
características físicas qualitativas
Os halogéneos com os outros podem ser muito diferentes, e que tem as seguintes propriedades físicas:
- Flr (F2), – um gás de cor amarela clara, tem um odor penetrante e irritante, e não são sujeitas a compressão em condições normais de temperatura. O ponto de fusão é de -220 ° C e o ponto de ebulição -188 ° C.
- Cloro (Cl 2) é um gás compressível não à temperatura ambiente, mesmo quando sob pressão, tem um odor pungente sufocação e uma cor amarela-verde. De fusão começa a -101 ° C e ferver a -34 ° C.
- Bromo (Br2), – um líquido volátil e pesada com uma cor castanha-marrom e odor fétido afiado. É funde a -7 ° C e entra em ebulição a 58 ° C.
- Iodo (I 2) – um agente de tipo sólido tem uma cor cinza escuro, e é característico brilho metálico, cheiro bastante acentuada. processo de fusão começa quando a 113,5 ° C e entra em ebulição a 184885 ° C.
- halogénio rara – é astatine (Na 2), que é um sólido e tem uma cor azul-preto com brilho metálico. O ponto de fusão corresponde a cerca de 244 ° C, começa a ferver e depois de atingir 309 ° C.
A natureza química de halogéneos
Halogéneo – os elementos com actividade oxidativa muito elevada que diminui na direcção de F em At. Flúor, como o representante mais activo de halogéneos, podem reagir com todos os tipos de metais, sem excluir qualquer conhecida. A maioria dos representantes dos metais que entram na atmosfera de flúor sofrer uma combustão espontânea, libertando assim o calor em grandes quantidades.
Sem aquecimento submetendo flúor que podem reagir com uma grande quantidade de não-metais, tais como H2, C, P, S, Si. O tipo de reacção, neste caso, é exotérmica e pode ser acompanhada por uma explosão. Aquecida, F leva para oxidar o remanescente de halogéneo, e sendo exposto à radiação, o elemento seja capaz de e reage com os gases pesados natureza inerte.
Ao interagir com os compostos do tipo complexo, flúor é uma reacção altamente energético, por exemplo, água de oxidação, que pode provocar uma explosão.

O reactivo pode também ser cloro, especialmente no estado livre. nível de atividade de menos de flúor, mas é capaz de reagir com quase todas as substâncias simples, mas o nitrogênio, oxigênio e gases nobres não reagem com ele. Interagir com hidrogénio, aquecendo o cloro ou boa iluminação cria burnoprotekayuschuyu reacção acompanhada por explosão.
Nas reacções de adição e substituição Cl podem reagir com uma grande quantidade de substâncias do tipo complexo. Capaz de deslocar Br e I, por aquecimento de um composto criado por eles com um metal ou de hidrogénio, e também pode reagir com substâncias alcalinas.
Bromo quimicamente menos ativa do que o cloro ou flúor, mas ainda se manifesta muito claramente. Isto é porque a maioria de bromo Br é utilizada como o líquido, porque nesta condição o grau de concentração inicial a outras condições iguais mais elevados do que Cl. Amplamente utilizado em química, especialmente orgânico. Pode ser dissolvido em H2O e parcialmente reagir com ele.
elemento halogéneo-iodo forma uma substância simples eu 2 e capaz de reagir com H 2 O, dissolvido na solução de iodeto, formando aniões complexos. A maioria de halogénio eu difere na medida em que não reage com a maioria dos representantes de não-metais e, lentamente, reage com os metais, neste caso, é necessário aquecer. Uma vez que o hidrogénio reage apenas exposto a calor intenso, e a reacção é endotérmica.
Rara astatine halogéneo (A) apresenta as reactividades de menos de iodo, mas podem reagir com metais. Como um resultado de dissociação ocorrer tanto aniões e catiões.
aplicações
compostos de halogénio são amplamente utilizados pelo homem em uma variedade de áreas. criolita natural (Na 3 AlF 6) é usado para preparar Al. Bromo e iodo substâncias como simples comumente usado empresas farmacêuticas e químicas. Na produção de peças para carros costumam usar halogênio. Lights – esta é uma daquelas peças. Qualitativamente escolher o material para esta parte da máquina é muito importante, como os faróis iluminar a estrada à noite, e um método para detectar você e outros motoristas. Um dos melhores materiais compósitos para criar faróis de xenônio considerados. Halogênio, no entanto, ligeiramente inferior em qualidade para o gás inerte.

Bom halogénio – é flúor, um aditivo geralmente utilizado no fabrico de dentífricos. Isso ajuda a evitar a ocorrência de doenças dentárias – cárie dentária.
Um tal elemento de halogéneo tal como cloro (Cl), encontra a sua aplicação na preparação de HCl, muitas vezes utilizada na síntese de substâncias orgânicas, tais como plástico, borracha, fibras sinticas, pigmentos, e solventes e semelhantes. D. E também os compostos de cloro são utilizados como agentes de branqueamento material de linho e algodão, de papel, e como um meio de controlo de bactérias em água potável.

Aviso! Tóxico!
Tendo em vista a reactividade muito elevada de halogéneos justamente chamado tóxico. Isto é mais claramente a capacidade de aderir a reacção expressa em flúor. Os halogéneos possuem propriedades fortes e sufocação capazes de prender o tecido interacção.
Flúor em pares e aerossóis é considerada uma das formas mais potencialmente perigosos de halogênio prejudiciais para os outros seres vivos. Isto é devido ao fato de que é mal percebida pelo cheiro e sentir apenas em atingir altas concentrações.
Resumindo
Como se pode ver, os halogéneos são uma parte muito importante da tabela periódica, eles têm muitas propriedades que diferem entre si em qualidades físicas e químicas, a estrutura atómica, o grau de oxidação e a capacidade de reagir com metais e não-metais. A indústria usa uma variedade de maneiras, que varia a partir de aditivos em produtos de higiene pessoal e terminando substâncias síntese de química orgânica ou branqueadores. Apesar do fato de que uma das melhores maneiras de manter e criar luz no farol do veículo é xenon, halogéneo, no entanto, não é inferior e também é amplamente utilizado e tem suas próprias vantagens.
Agora você sabe o que um halo. Crossword com qualquer dúvida sobre essas substâncias para você não é mais um obstáculo.














