testes qualitativos sobre fenol. Preparação de fenóis: Reacção
ácido carbólico – um dos Fenol nomes, indicando o seu comportamento especial em processos químicos. Este material é mais fácil do que o benzeno entra em reacção de substituição nucleofílica. As propriedades inerentes de um composto são explicados mobilidade átomo de hidrogénio ácido no grupo hidroxilo ligado ao anel. O estudo da estrutura molecular e da resposta de alta qualidade para permitir que o composto de fenol incluem compostos aromáticos – derivados de benzeno.
Fenol (hidroxibenzeno)
Em 1834, um químico alemão Runge atribuída ácido carbólico de alcatrão de carvão, mas foi incapaz de decifrar a sua composição. Mais tarde, outros investigadores propuseram uma fórmula, e realizada uma nova ligação para os álcoois aromáticos. O representante mais simples deste grupo – fenol (hidroxibenzeno). Na sua forma pura, esta substância é um cristal transparente que tem um odor característico. cor ar-fenol pode mudar para se tornar rosa ou vermelho. Para aromático álcool típica fraca solubilidade em água fria e boa – em solventes orgânicos. Fenol funde a uma temperatura de 43 ° C. É um composto tóxico, em contacto com a pele provoca queimaduras graves. O radical aromático é um radical de fenilo (C6H5-). Directamente com um dos átomos de carbono de oxigénio está ligado com um grupo hidroxilo (-OH). A presença de cada uma das partículas mostra reacção qualitativas adequadas para fenol. A fórmula que mostra o conteúdo total de átomos de elementos químicos na molécula – C6H6O. Estrutura reflectir fórmula estrutural, incluindo ciclo e grupo funcional Kekule – hidroxilo. Uma representação visual da molécula, um álcool aromático dar modelo sharosterzhnevye.
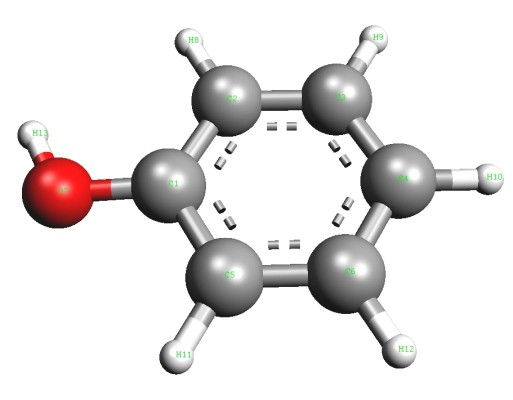
As características da estrutura molecular
Interferência do anel de benzeno e o grupo OH define reacção química de fenol com metais, halogéneos, outras substâncias. Após ter ligado ao anel aromático do átomo de oxigénio conduz a uma redistribuição da densidade electrónica na molécula. Comunicação O-H é mais polar, o que resulta em aumento da mobilidade do hidrogénio no grupo hidroxilo. O protão pode ser substituído por átomos de metal, o que indica que a acidez do fenol. Por sua vez, o grupo OH aumenta as propriedades reactivas do anel de benzeno. Deslocalização de electrões aumenta, e a capacidade de substituição electrofílica no núcleo. Isto aumenta a mobilidade dos átomos de hidrogénio ligados ao átomo de carbono na posição para e orto (2, 4, 6). Este efeito é devido à presença do doador de electrões densidade – grupo hidroxilo. Devido à sua influência fenol activo do que o benzeno se comporta em reacções com certas substâncias e novos substituintes orientados nas orto- e para- posições.
As propriedades ácidas
O grupo hidroxilo do álcool átomo de oxigénio aromático adquire uma carga positiva, enfraquecendo a sua comunicação com hidrogénio. libertação de protões é facilitada, de modo fenol comporta-se como um ácido fraco, mas mais forte do que os álcoois. reacção qualitativa de fenol incluem teste decisivo teste na presença de protões muda de cor de azul para rosa. A presença de átomos de halogéneo ou grupos nitro associada com o anel de benzeno conduz a um aumento na actividade de hidrogénio. O efeito é observado nas moléculas nitro fenol. substituintes de acidez inferior tal como um grupo amino, e alquilo (CH3-, C2H5-, etc.). Os compostos que reúne um anel benzeno, um grupo hidroxilo e um radical metilo, refere-cresol. As suas propriedades são mais fracos do que o ácido carbólico.
reacção com fenol e de sódio alcalino
 Do mesmo modo os ácidos fenol é feito reagir com metais. Por exemplo, reage com o sódio: 2C6H5-OH + 2Na = 2C6H5-ONa + H2 ↑. Formou-se fenóxido de sódio, e hidrogénio gasoso é libertado. O fenol é feito reagir com bases solúveis. Ela ocorre reacção de neutralização para formar um sal e água: C6H5-OH + NaOH = C6H5 -ONa + H2O. A capacidade para se obter hidrogénio no grupo hidroxilo na fenol é mais baixa do que a maioria dos ácidos inorgânicos e carboxílicos. Ele desloca-lo a partir dos sais dissolvidos na água mesmo dióxido de carbono (ácido carbónico). equação de reacção: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
Do mesmo modo os ácidos fenol é feito reagir com metais. Por exemplo, reage com o sódio: 2C6H5-OH + 2Na = 2C6H5-ONa + H2 ↑. Formou-se fenóxido de sódio, e hidrogénio gasoso é libertado. O fenol é feito reagir com bases solúveis. Ela ocorre reacção de neutralização para formar um sal e água: C6H5-OH + NaOH = C6H5 -ONa + H2O. A capacidade para se obter hidrogénio no grupo hidroxilo na fenol é mais baixa do que a maioria dos ácidos inorgânicos e carboxílicos. Ele desloca-lo a partir dos sais dissolvidos na água mesmo dióxido de carbono (ácido carbónico). equação de reacção: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
As reacções do anel de benzeno
propriedades aromáticas são devidos a deslocalização de electrões no núcleo de benzeno. Hidrogénio a partir do anel é substituído por átomos de halogéneo, nitro. Um processo semelhante na molécula de fenol é mais fácil do que a de benzeno. Um exemplo – a bromação. Benzeno halogéneo opera na presença de catalisador, bromobenzeno obtido. O fenol é feito reagir com água de bromo, sob condições normais. A interacção de um precipitado branco de 2,4,6-tribromofenol, cuja aparência de distinguir a substância de ensaio semelhante a ela a partir de compostos aromáticos. A bromação – reacção qualitativa para fenol. Equação: C6H5-OH + 3Br2 + = C6H2Br3 HBr. O segundo produto de reacção – brometo de hidrogénio. Quando se faz reagir com fenol diluído ácido nítrico nitro derivado. O produto da reacção com um ácido nítrico concentrado – 2,4,6-trinitrofenol ou ácido pícrico tem grande significado prático.
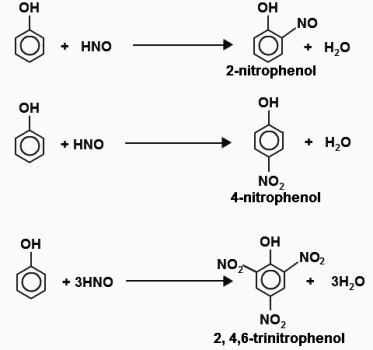
testes qualitativos sobre fenol. lista
No interacção de substâncias obtida certos alimentos que lhe permitem definir a composição qualitativa dos materiais de partida. Um número de reacção de cor indica a presença de partículas, os grupos funcionais que são úteis para a análise química. reacção qualitativa de provar a existência de fenol por cada molécula de substância do anel e grupos OH aromáticos:
- A solução de fenol azul o papel de tornassol vermelho.
- fenóis de reacção coloridos também realizada num meio básico fraco com sais de diazónio. Um amarelo ou laranja corantes azo.
- É feito reagir com água precipitado castanho bromo aparece tribromofenol branco.
- Na reacção com uma solução de cloreto férrico fenóxido obtido férrico – azul substância, violeta ou coloração verde.

obtendo fenóis
Produção de fenol na indústria é em duas ou três etapas. Na primeira fase do propileno e de benzeno na presença de cloreto de alumínio produzido de cumeno (isopropilbenzeno nome comum). A equação da reacção da reacção de Friedel-Crafts: C6H5-OH + C3H6 = C9H12 (cumeno). O benzeno e o propileno em uma proporção de 3: 1 é passado sobre um catalisador ácido. Cada vez mais, em vez da tradicional catalisador – cloreto de alumínio – ecologicamente zeólitos puros. Na fase final da oxidação é realizada com oxigénio na presença de ácido sulfúrico: C6H5-C3H7 + O2 = C6H5-OH + C3H6O. Os fenóis podem ser derivados de destilação de carvão, são intermediários na produção de outras substâncias orgânicas.
O uso de fenóis
álcoois aromáticos são amplamente utilizados na indústria de plásticos, corantes, pesticidas e outras substâncias. a produção de ácido carbólico de benzeno é o primeiro passo na criação de um número de polímeros, incluindo policarbonatos. O fenol é feito reagir com formaldeído, resinas de fenol-formaldeído são obtidos.

Ciclo-hexanol é a matéria-prima para a produção de poliamidas. Fenóis são utilizados como anti-sépticos e desinfectantes em desodorantes, loções. Utiliza-se para se obter fenacetina, ácido salicílico e outros medicamentos. Fenóis são usados na produção de resinas que são usadas em produtos eléctricos (interruptores, tomadas). Eles são também utilizados na preparação de corantes azo, tais como fenilamina (anilina). ácido pícrico, derivados nitro de fenol que é aplicada para o tingimento, o fabrico de explosivos.















