Como é sabido, proteínas – a base da origem da vida no nosso planeta. De acordo com a teoria de Oparin-Haldane foi queda coacervato, composta por moléculas de peptídeos, tornou-se a base de origem dos seres vivos. Isto é, sem dúvida porque a análise da estrutura interna de qualquer membro da biomassa mostra que estas substâncias têm de tudo: plantas, animais, microorganismos, fungos, vírus. E eles são de natureza muito diversa e macromolecular.
Os nomes dessas quatro estruturas, eles são sinônimos:
- proteínas;
- proteínas;
- polipéptidos;
- péptidos.

moléculas de proteínas
O seu número é realmente incalculável. Neste caso, todas as moléculas de proteína podem ser divididos em dois grupos principais:
- Simples – consistir apenas de sequências de aminoácidos ligados por ligações peptídicas;
- complexo – Estrutura e estrutura de uma proteína são caracterizados por os grupos adicionais protolytic (prótese), também chamadas de cofactores.
Neste caso, as moléculas complexas também têm a sua própria classificação.
péptidos complexos de gradação
- Glicoproteínas – estão associadas de perto compostos de proteína e de hidratos de carbono. A estrutura da molécula de tecido grupos prostéticos mucopolissacarídeos.
- Lipoproteínas – um composto complexo de proteína e lípido.
- Metaloproteínas – como um grupo prostético são os iões metálicos (ferro, manganês, cobre, e outros).
- Nucleoproteínas – proteína feedback e ácidos nucleicos (ADN, ARN).
- Fosfoproteidy – conformação da proteína e um resíduo de ácido fosfórico.
- Chromoproteids – muito semelhantes a metaloproteínas, mas um elemento que faz parte do grupo prostético é um complexo corado (vermelho – hemoglobina, verde – clorofila, e assim por diante).
Cada grupo discutida a estrutura e propriedades das proteínas são diferentes. As funções que desempenham, e irão variar dependendo do tipo de molécula.

A estrutura química de proteínas
A partir deste ponto de vista proteínas – uma longa, cadeia maciço de resíduos de aminoácidos ligados entre si laços específicos chamados péptido. Do lado ácidos estruturas partem ramo – radicais. Esta estrutura da molécula foi descoberto por E. Fischer, no início do século XXI.
Mais tarde, as proteínas, estrutura e função de proteínas têm sido estudados com mais pormenor. Tornou-se claro que os aminoácidos constituindo a estrutura do péptido, um total de 20, mas eles podem, assim, ser combinadas de diferentes maneiras. Daí a diversidade de estruturas polipeptídicas. Além disso, no processo de vida e o desempenho das suas funções de proteínas são capazes de passar por uma série de transformações químicas. Como resultado, eles mudam a estrutura, e há muito um novo tipo de conexão.
Para quebrar a ligação de péptidos, isto é, interromper a estrutura da proteína de cadeias devem ser escolhidos condições muito rigorosas (temperaturas elevadas, o catalisador ácido ou alcalino). Isto é devido à elevada resistência das ligações covalentes na molécula, nomeadamente, no grupo de péptidos.

A detecção da proteína estrutura no laboratório é realizada utilizando a reacção de biureto – efeito sobre polipéptido recém precipitados de hidróxido de cobre (II). O complexo de iões de cobre e de grupo péptido proporciona uma cor violeta brilhante.
Há quatro organização estrutural básica, cada um dos quais tem suas próprias características da estrutura de proteínas.
Níveis de organização: a estrutura primária
Como mencionado acima, o péptido – uma sequência de resíduos de aminoácidos com inclusões, co-enzimas, ou sem eles. Então chamar esta estrutura primária da molécula, o que é natural, é claro, são os verdadeiros aminoácidos unidos por ligações peptídicas, e nada mais. Ou seja, a estrutura polipeptídica linear. Nesta estrutura em particular das proteínas deste tipo – em que esta combinação de ácidos é crucial para o desempenho das funções da molécula de proteína. Graças a esses recursos é possível não só para identificar péptidos, mas também para prever as propriedades e o papel de uma inteiramente nova, ainda desconhecida. Exemplos de péptidos que possuem a estrutura primária naturais, – insulina, pepsina, quimotripsina, e outros.
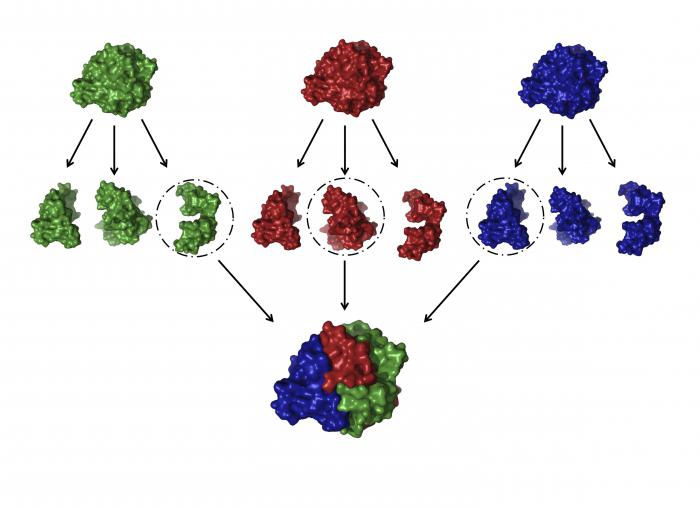
conformação secundária
Estrutura e propriedades das proteínas nesta categoria variam um pouco. Uma tal estrutura pode ser formado inicialmente sobre a natureza ou quando sujeitos a hidrólise primário rígida, temperatura ou outras condições.
Esta conformação tem três variedades:
- Lisas e regulares, bobinas estereoregulares construídos a partir dos resíduos de aminoácidos que são torcidos em torno do eixo de ligação de núcleo. Apenas mantidas juntas por ligações de hidrogénio que ocorrem entre o grupo oxigénio de um péptido e o outro hidrogénio. Em que a estrutura é correcto, devido ao fato de que as voltas repetidas uniformemente todos os quatro níveis. Tal estrutura pode ser tanto com a mão esquerda e pravozakruchennoy. Mas proteínas na maioria conhecidos destrorrotatórias predomina isômeros. Tal conformação é chamada alfa-estruturas.
- A composição e a estrutura da seguinte proteína de tipo diferente da anterior na medida em que as ligações de hidrogénio não são formadas entre o lado que está pelo lado de um lado da parte restante da molécula e entre substancialmente removida, em que a uma distância suficientemente grande. Por esta razão, toda a estrutura torna-se, cadeias polipeptídicas cobra convolutos mais ondulantes. Há uma característica que deve ser proteína. A estrutura dos aminoácidos dos ramos deve ser tão curto como o de glicina ou alanina, por exemplo. Este tipo de conformação secundária é chamada beta-folhas por sua capacidade de ficar juntos, se a formação da estrutura global.
- Que pertencem à terceira estrutura da proteína tipo como a biologia indica raznorazbrosannye complexo, fragmentos não ordenadas não tendo estereoregularidade e capaz de modificar a estrutura sob a influência de condições externas.
Exemplos de proteínas que possuem a estrutura secundária, por natureza, não é revelado.

ensino superior
Esta é uma conformação bastante complexo, com o nome "glóbulo". O que é uma proteína? A estrutura do mesmo baseia-se na estrutura secundária, mas adicionou novos tipos de interacções entre os átomos de grupos, e toda a molécula de dobras como, guiada por isso, o facto de que os grupos hidrófilos têm sido dirigidos em glóbulos e hidrofóbico – para fora.
Isto explica a carga da molécula de proteína em soluções coloidais de água. Quais são os tipos de interações são lá?
- As ligações de hidrogénio – permanecem inalteradas entre as mesmas partes da estrutura secundária.
- O grupo hidrofóbico (hidrófilo) interacção – surgem quando dissolvido em água polipéptido.
- Iónico atracção – raznozaryazhennymi formada entre os resíduos de aminoácidos grupos (radicais).
- interacções covalentes – pode ser formado entre os locais específicos ácidas – moléculas de cisteína, ou seja, as suas caudas.
Assim, a composição e estrutura de proteínas que têm uma estrutura terciária pode ser descrito como um enrolado em cadeias polipeptídicas glóbulos, de retenção e de estabilização a sua conformação devido aos vários tipos de interacções químicas. Exemplos de tais péptidos: fosfoglitseratkenaza, ARNt, alfa-queratina, de fibroína de seda, e outros.
A estrutura quaternária
Este é um dos mais difíceis dos glóbulos, que formam as proteínas. A estrutura e função das proteínas de uma tal planta é muito versátil e específico.
O que é essa conformação? É algumas dezenas (por vezes) de cadeias de polipéptidos grandes e pequenos, que são formados de forma independente um do outro. Mas, em seguida, devido aos mesmos interações que temos considerado para a estrutura terciária destes peptídeos são torcidos e interligados. Assim obtido glóbulos conformacionais complexos que podem conter átomos de metal, e os grupos lipídicos e hidratos de carbono. Os exemplos de tais proteínas: a polimerase de ADN, proteínas envelope do vírus tabaco, hemoglobina, e outros.

Todas as estruturas peptídicas que discutimos têm os seus próprios métodos de identificação no laboratório, com base em possibilidades actuais de utilização de cromatografia, centrifugação, electrões e microscopia óptica e altas tecnologias de computador.
funções
A estrutura e função das proteínas está intimamente correlacionada com o outro. Ou seja, cada peptídeo desempenha um papel que é único e específico. Há também aqueles que são capazes de realizar em uma célula viva, várias operações significativas. Mas pode ser resumido como a expressar as funções básicas de moléculas de proteína nos corpos dos seres vivos:
- Proporcionar tráfego. organismos unicelulares ou organelos, ou certos tipos de células são capazes de movimento, cortes, movimentos. Esta proteína é fornecida, que faz parte da sua estrutura do aparelho do motor: cílios, flagelos, membrana citoplasmática. Se estamos a falar da incapacidade de deslocação das células, as proteínas podem contribuir para a sua redução (músculo miosina).
- função nutricional ou backup. É uma acumulação de moléculas de proteínas em oócitos, embriões de plantas e sementes para as outras falta de enchimento nutrientes. Após clivagem dos péptidos produzir aminoácidos e substâncias biologicamente activas, que são necessários para o desenvolvimento normal dos organismos vivos.
- A função de energia. Para além dos hidratos de carbono força o corpo pode produzir e proteínas. No decaimento de 1 g de péptido libertado 17,6 kJ energia útil na forma de trifosfato de adenosina (ATP), que é gasto em processos vitais.
- Sinal e função reguladora. Ele consiste na realização de uma monitorização cuidadosa dos processos em curso e a transmissão de sinais de celular para o tecido, a partir deles para as autoridades, a partir do mais recente para o sistema e assim por diante. Um exemplo típico é a insulina, a qual é estritamente grava o número de glucose no sangue.
- função do receptor. É conseguida alterando a conformação do péptido com um lado da membrana e engatar a outra extremidade de reestruturação. Quando isso ocorre e a transmissão do sinal e as informações necessárias. A maior parte destas proteínas são incorporados na membrana citoplasmática de células e efectuar um controlo rigoroso sobre todo o material de passagem através do mesmo. Também alertá-lo sobre as mudanças químicas e físicas no ambiente.
- função de transporte de péptidos. É levada a cabo alimenta proteínas e proteínas transportadoras. O seu papel é óbvio – o transporte de moléculas desejáveis para os locais com uma baixa concentração das partes elevadas. Um exemplo típico é o transporte de oxigénio e dióxido de carbono a partir dos órgãos e tecidos do proteína hemoglobina. Eles também têm alcançado a entrega de compostos com um baixo peso molecular através da membrana para a célula.
- função estrutura. Um dos mais importantes daqueles que executa proteína. A estrutura das células e os seus organelos é fornecido péptidos. Eles são semelhantes à armação definir a forma e estrutura. Além disso, eles também apoiá-lo, e modificar, se necessário. Portanto, para o crescimento e desenvolvimento de todos os organismos vivos proteínas essenciais na dieta. Tais péptidos incluem elastina, tubulina, o colagénio, a actina, e outras queratina.
- A função catalítica. Sua realizando enzimas. Muitos e variados, eles aceleram todas as reações químicas e bioquímicas no corpo. Sem a sua participação, maçã comum no estômago seria capaz de digerir apenas para dois dias, é provável que dobrar ao mesmo tempo. Sob a acção da catalase, peroxidase e outras enzimas, este processo realiza-se em duas horas. Em geral, é graças a esse papel, o anabolismo proteico e catabolismo é realizada, isto é, plástico e metabolismo energético.

O papel protetor
Existem vários tipos de ameaças, das quais proteínas são projetados para proteger o corpo.
Em primeiro lugar, de ataque químico traumáticas reagentes, gases, moléculas, substâncias espectro de acção diferente. Os péptidos são capazes de interagir com eles de uma reacção química, converter em uma forma inofensiva ou simplesmente neutralizar.
Em segundo lugar, a ameaça física do ferimento – se a proteína fibrinogênio em tempo não é transformado em fibrina no local da lesão, o sangue não coagula, e, portanto, o bloqueio ocorrerá. Em seguida, pelo contrário, precisa de péptido plasmina capaz coágulo sugado e restaurar a desobstrução do vaso.
Em terceiro lugar, a ameaça de imunidade. Estrutura e valor das proteínas que formam as defesas imunitárias, são extremamente importantes. Anticorpos, imunoglobulinas, interferons – são elementos importantes e significativos do sistema linfático e imunológico. Quaisquer partículas estranhas, molécula malicioso, as células mortas ou uma parte de toda a estrutura é submetida a uma investigação imediata pelo composto peptico. É por isso que uma pessoa pode possuir, sem a ajuda de drogas todos os dias para se protegerem da infecção e vírus simples.
Propriedades físicas
A estrutura das células de proteínas é muito específico e depende da função. Mas as propriedades físicas dos péptidos são semelhantes e podem ser reduzidos para as seguintes características.
- moléculas de peso – a 1000000 Daltons.
- Em solução aquosa a formar o sistema coloidal. Há adquire estrutura cobrar capaz variam dependendo da acidez do meio.
- Quando exposto a condições severas (radiação, ácido ou alcalino, temperatura, etc.) são capazes de se deslocar para outras conformações níveis, isto é, desnaturar. O processo em 90% dos casos irreversíveis. No entanto, há um deslocamento inverso – renaturação.
Estas propriedades básicas de características físicas dos péptidos.















