Eletrólitos são os produtos químicos conhecidos desde os tempos antigos. No entanto, a maioria das áreas da sua aplicação, eles ganharam recentemente. Vamos discutir a prioridade para a indústria o uso destas substâncias e vamos entender que o passado é o presente, e diferem uns dos outros. Mas vamos começar com uma digressão na história.

história
Os eletrólitos mais antigos conhecidos – sais e ácidos é aberto mesmo no mundo antigo. No entanto, a compreensão da estrutura e propriedades de eletrólitos têm evoluído ao longo do tempo. Teoria estes processos evoluíram desde 1880, quando foi feita uma série de descobertas, teorias relacionadas com as propriedades do eletrólito. Havia vários saltos quânticos em teorias que descrevem os mecanismos de interação dos eletrólitos com água (na verdade apenas em solução adquirem as propriedades que tornam a sua utilização na indústria).
Agora vamos ver exatamente diversas teorias que tiveram o maior impacto sobre o desenvolvimento de conceitos de eletrólitos e suas propriedades. Vamos começar com a teoria mais comum e simples, que cada um de nós teve na escola.
teoria de Arrhenius de dissociação electrolítica
Em 1887, o químico sueco Svante Arrhenius e russo-alemão químico Wilhelm Ostwald desenvolveu a teoria da dissociação eletrolítica. No entanto, aqui, também, não é tão simples. si de Arrhenius era torcedor chamada teoria física de soluções que não levam em conta a interacção dos componentes da substância com água e afirmaram que existem partículas carregadas livres (iões) em solução. By the way, a partir de tais posições hoje estão considerando a dissociação eletrolítica da escola.
Falamos todos a mesma que faz com que a teoria e como ele explica o mecanismo de interação de substâncias com água. Tal como acontece com qualquer outro trabalho, ele tem vários postulados que ele usa:
1. Na reacção de água com a substância se desintegra em iões (positivo – negativo e de catiões – aniónicas). Estas partículas são submetidas a hidratação eles atraem moléculas de água o que, aliás, é carregadas por um lado de forma positiva e, por outro – negativa (dipolo formado) para formar complexos em Aqua (solvatos).
2. O processo de dissociação é reversível – isto é, se a substância for dividida em iões, sob a influência de qualquer elemento, pode tornar-se novamente uma fonte.
3. Se os eléctrodos de conexão para a solução e deixar que a corrente, os catiões irá começar a mover-se para o eléctrodo negativo – o cátodo e aniões para o carregado positivamente – ânodo. É por isso que as substâncias são facilmente solúveis em água, conduzem electricidade melhor do que a própria água. Pela mesma razão, eles são chamados de eletrólitos.
4. O grau de dissociação do electrólito caracteriza percentagem substância submetida a dissolução. Esta taxa depende do solvente e das propriedades do soluto, a concentração deste último e da temperatura externa.
Aqui, de fato, e todos os princípios básicos desta teoria simples. -Los, vamos utilizar neste artigo para uma descrição do que está acontecendo na solução eletrolítica. Exemplos destes compostos Vamos examinar um pouco mais tarde, e agora vamos considerar uma outra teoria.

ácidos e bases de Lewis Teoria
De acordo com a teoria de dissociação electrolitica, ácido – uma substância presente em uma solução cujo catião hidrogénio e base – composto decompõe-se em solução a um anião hidróxido. Há uma outra teoria, nomeado após o famoso químico Gilbert Lewis. Ele permite que você estender o conceito de vários ácidos e bases. De acordo com a teoria de Lewis, o ácido – é os iões ou moléculas de substâncias que têm orbitais de electrões livres e são capazes de aceitar um electrão a partir de outra molécula. Fácil de imaginar que as bases irão ser aquelas partículas que são capazes de dar um ou mais de seus electrões para o ácido "utilização". É interessante aqui é que o ácido ou base pode ser não só o electrólito mas também qualquer substância que, mesmo insolúvel em água.

teoria Protolytic Brendsteda Lowry
Em 1923, independentemente um do outro, dois cientistas – J. e T. teoria Lowry Bronsted -predlozhili, que agora é utilizada activamente por cientistas para descrever os processos químicos. A essência desta teoria é que a dissociação do significado vem para baixo para uma transferência de protões a partir da base de ácido. Assim, o último é aqui entendida como um aceitador de protões. Em seguida, o ácido é o seu doador. A teoria explica também a existência de uma boa substâncias que exibem propriedades e ácidos e bases. Tais compostos são chamados anfotérico. Em teoria de Bronsted-Lowry para o seu termo também se aplica anfólitos, enquanto comummente chamados protolitos de ácido ou base.
Viemos para a próxima seção. Aqui vamos mostrar-lhe o que diferentes eletrólitos fortes e fracos, e discutir o impacto de fatores externos em suas propriedades. E, em seguida, para avançar para a descrição da sua aplicação prática.
eletrólitos fortes e fracos
Cada substância reage com a água por si só. Alguns dissolvem bem (por exemplo, cloreto de sódio), e alguns não se dissolvem (por exemplo, giz). Assim, todas as substâncias são divididas em eletrólitos fortes e fracos. Estes últimos são substâncias que interagem fracamente com água e depositados no fundo da solução. Isto significa que elas têm um grau muito baixo de dissociação e as ligações de alta energia, o que permite que a molécula a desintegrar-se nos seus iões de componentes, sob condições normais. A dissociação electrólitos fracos ocorre tanto lentamente ou por aumento da temperatura e da concentração da substância em solução.
Fale sobre um eletrólito forte. Estes incluem todos os sais solúveis em água, assim como ácidos fortes e álcalis. Eles são fáceis de quebrar em íons e é muito difícil para coletá-los na chuva. A corrente do electrólito, incidentalmente, é realizado graças aos iões contidos na solução. Portanto, as melhores eletrólitos fortes condutores. Exemplos destes últimos: ácidos fortes, bases, sais solúveis.
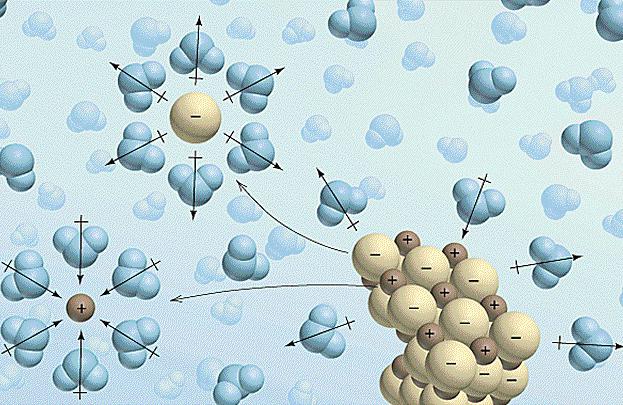
Fatores que afetam o comportamento de eletrólitos
Agora olhe como a mudança afeta o ambiente externo sobre as propriedades das substâncias. A concentração afecta directamente o grau de dissociação do electrólito. Além disso, esta relação pode ser expressa matematicamente. A lei que descreve esta relação, chamada de lei de diluição de Ostwald e é escrita como: a = (K / c) 1/2. Aqui, um – é o grau de dissociação (tomado como uma fracção), K – constante de dissociação, diferente para cada uma das substâncias, e com – a concentração de electrólito na solução. De acordo com esta fórmula, você pode aprender muito sobre o assunto e seu comportamento em solução.
Mas se desviaram do assunto. A concentração adicional do grau de dissociação de electrólito também afecta a temperatura. Para a maioria das substâncias aumentam aumenta a solubilidade e a reactividade. Isto pode explicar a ocorrência de determinadas reacções apenas com temperatura elevada. Sob condições normais, que são ou muito lentamente, ou em ambas as direcções (este processo é chamado reversível).
Examinámos os factores que determinam o comportamento de um sistema, tais como uma solução de electrólito. Agora vamos passar para a aplicação prática destes, sem dúvida, substâncias químicas muito importantes.
aplicação industrial
Claro, todo mundo já ouviu o "eletrólito" palavra como aplicada às baterias. Em um veículo usando baterias de chumbo-ácido, o electrólito no qual desempenha o papel de um ácido sulfúrico a 40 por cento. Para entender por que não é tudo que você precisa é uma substância necessária para entender as características da bateria.
Então, qual é o princípio de funcionamento de qualquer bateria? Na reacção reversível, que terá lugar a conversão de uma substância no outro, como um resultado da qual os electrões são libertados. Quando a interação carga da bateria ocorre substâncias, o que é impossível em condições normais. Isto pode ser representado como a acumulação de energia no material como resultado de uma reacção química. Quando se descarrega a transformação inversa começa, reduzindo o sistema para o estado inicial. Estes dois processos, juntos, constituem um ciclo de carga-descarga.
Considere o processo anterior é um exemplo específico – a bateria de chumbo-ácido. Como é fácil de imaginar, a fonte de corrente é constituído por um elemento, compreendendo uma ligação (de chumbo PbO diokisd e 2) e um ácido. Qualquer bateria consiste de eletrodos e o espaço entre eles preenchido apenas com o eletrólito. Quanto a este último, como já vimos, neste exemplo usa concentração de ácido sulfúrico de 40 por cento. O cátodo da bateria feita a partir de dióxido de chumbo, o ânodo é feito de chumbo puro. Tudo isto é porque estes dois eléctrodos diferentes ocorrem reacções reversíveis que envolvem iões que são ácido dissociado:
- PbO 2 + SO 4 2- + 4H + + 2e – = PBSO 4 + 2H 2 O (a reacção que ocorre no eléctrodo negativo – cátodo).
- Pb + SO 4 2- – 2e – = PbSO4 (a reacção que ocorre no eléctrodo positivo – o ânodo).
Se você ler a reação da esquerda para a direita – obter os processos que ocorrem durante a descarga da bateria, e se direito – em um cargo. Cada fonte de corrente química destas reacções é diferente, mas o mecanismo da sua ocorrência em geral descreve a mesma: existem dois processos, um dos quais electrões são "absorvido" e o outro, pelo contrário, "ir." A coisa mais importante é que o número de elétrons absorvidos igual ao número publicado.
Na verdade, além de baterias, existem muitas aplicações destas substâncias. Em geral, eletrólitos, exemplos dos quais temos dado, – é apenas um grão da variedade de substâncias que são unidos sob este termo. Eles nos cercam todos os lugares, em todos os lugares. Por exemplo, o corpo humano. Você acha que não há tais substâncias? Muito errado. Eles são encontrados em todos os lugares em nós e constituem o maior número de eletrólitos no sangue. Estes incluem, por exemplo, iões de ferro, que são parte de hemoglobina e ajuda a transportar oxigénio para os tecidos do nosso corpo. eletrólitos no sangue também desempenham um papel fundamental na regulação do equilíbrio de água-sal e o trabalho do coração. Esta função é realizada por iões de potássio e de sódio (não é ainda um processo que ocorre em células que são denominados bomba de potássio-sódio).
Qualquer substância que você é capaz de dissolver pelo menos um pouco – eletrólitos. E não há nenhuma indústria e as nossas vidas, onde quer que eles são aplicados. Não são apenas as baterias em carros e baterias. É qualquer processamento químico e de alimentos, fábricas militares, fábricas de vestuário e assim por diante.
A composição do electrólito, a propósito, é diferente. Assim, é possível atribuir o electrólito ácido e alcalino. Eles diferem fundamentalmente em suas propriedades: como já dissemos, os ácidos são doadores de prótons, e alcalinos – aceitantes. Mas, ao longo do tempo, a composição de electrólito alterações devido à perda de parte da concentração da substância quer diminui ou aumenta (tudo depende do que é perdida, a água ou o electrólito).
Todos os dias somos confrontados com eles, mas muito poucas pessoas sabem exatamente a definição de um termo como eletrólitos. Exemplos de substâncias específicas que discutimos, então vamos passar para um pouco de conceitos mais complexos.

As propriedades físicas dos electrólitos
Agora sobre a física. A coisa mais importante para entender no estudo deste tema – a corrente é passada para os eletrólitos. papel decisivo neste desempenhado pelos íons. Estas partículas carregadas podem migrar a partir de uma parte da solução de carga para outro. Assim, aniões tendem sempre para o eléctrodo positivo e de catiões – para a negativa. Assim, agindo sobre a solução corrente elétrica, dividimos as acusações em lados opostos do sistema.
características físicas muito interessantes, tais como densidade. Ela afeta muitas propriedades dos nossos compostos em discussão. E muitas vezes aparece a pergunta: "Como aumentar a densidade do eletrólito" Na verdade, a resposta é simples: é necessário para reduzir o teor de água da solução. Uma vez que a densidade do electrólito principalmente determinada densidade do ácido sulfúrico, isso depende em grande medida da concentração final. Há duas maneiras de implementar o plano. O primeiro é bastante simples: ferver o eletrólito contido na bateria. Para fazer isso, você precisa carregá-lo para que a temperatura no interior subiu ligeiramente acima de cem graus Celsius. Se este método não funcionar, não se preocupe, há outra: basta substituir o velho novo eletrólito. Para fazer isso, drenar a solução antiga para limpar o interior do ácido sulfúrico residual em água destilada, e depois verter uma nova porção. Tipicamente, a qualidade das soluções de electrólitos imediatamente tem um valor de concentração desejado. Após a substituição pode esquecer sobre como aumentar a densidade do eletrólito.
A composição do electrólito determina em grande parte as suas propriedades. Características, tais como a condutividade eléctrica e a densidade, por exemplo, dependem fortemente da natureza do soluto e da sua concentração. Há uma questão separada de quanto do eletrólito na bateria pode ser. Na verdade, o seu volume está diretamente relacionada com a capacidade declarada do produto. O ácido sulfúrico mais no interior da bateria, portanto, é mais poderoso, t. E. O mais tensão é capaz de produzir.

Onde é útil?
Se você é um entusiasta de carro ou apenas interessado em carros, você vai entender tudo sozinho. Certamente você mesmo sabe como determinar a quantidade de eletrólito da bateria é agora. E se você estiver longe do carro, então o conhecimento das propriedades dessas substâncias, a sua utilização e como eles interagem uns com os outros não será supérfluo. Sabendo disso, você não está confuso, você está convidado a dizer o que o eletrólito na bateria. Embora, mesmo se você não é um entusiasta do carro, mas você tem um carro, então o conhecimento do dispositivo de bateria vai ser absolutamente nenhum dano e irá ajudá-lo a reparar. Será muito mais fácil e barato fazer tudo sozinho, do que ir ao centro de carro.
E para saber mais sobre este tema, recomendamos que você verifique o livro didático de química para as escolas e universidades. Se você conhece esta ciência bem e ler bastante livros, a melhor opção será "fontes atuais Químicas" Varypaeva. Não são definidos em detalhes toda a teoria da vida útil da bateria, uma variedade de baterias e elementos de hidrogênio.
conclusão
Chegamos ao fim. Vamos resumir. Acima discutimos tudo, como existe tal coisa como eletrólitos: exemplos, teoria da estrutura e as propriedades, funções e aplicações. Mais uma vez, deve-se dizer que estes compostos são parte da nossa vida, sem o qual não poderia existir, o nosso corpo e todas as áreas da indústria. Você se lembra dos eletrólitos no sangue? Graças a eles vivemos. E o que dizer de nossos carros? Com esse conhecimento podemos corrigir qualquer problema com a bateria, como agora entender como aumentar a densidade do eletrólito nele.
Todos impossível dizer, mas nós não definir essa meta. Afinal, não é tudo que pode ser dito sobre estas substâncias surpreendentes.