substâncias puras: exemplos. Preparação de substâncias puras
Toda a nossa vida está literalmente construída sobre o trabalho de vários produtos químicos. Nós respirar ar que contém uma pluralidade de diferentes gases. A saída é o dióxido de carbono, o qual é então processado plantas. Nós beber água ou leite, que é uma mistura de água com outros componentes (de gordura, minerais, proteínas, etc.).
maçã Banal – é um conjunto de produtos químicos complexos que interagem uns com os outros e pelo corpo. Assim que algo fica no nosso estômago, substâncias contidas no produto, temos absorvido, começam a interagir com o suco gástrico. Cada objecto: um homem, um vegetal, um animal – um conjunto de partículas e substâncias. Estes últimos são divididos em dois tipos diferentes: as substâncias puras e misturas. Neste artigo vamos entender o que substâncias são limpos e que são classificados como misturas. Considere métodos para a separação de misturas. Também olhar para os exemplos típicos de substâncias puras.

substâncias limpas
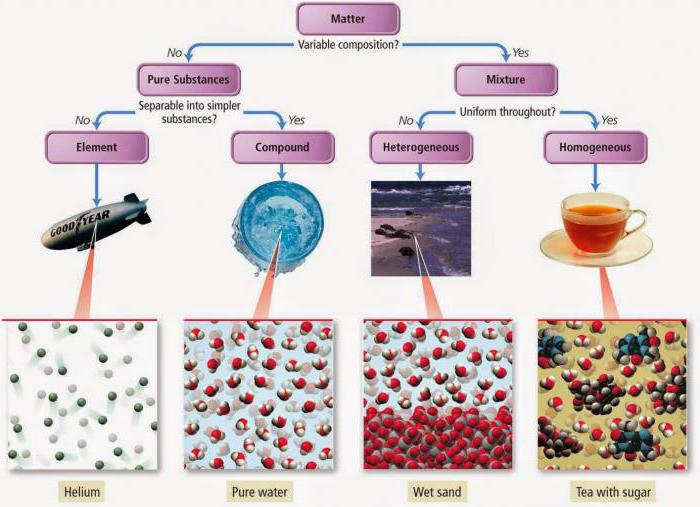
Então, na química substâncias limpas – as substâncias que sempre consistem de apenas um único tipo de partícula. E esta é a primeira propriedade importante. substância pura é a água, por exemplo, que consiste unicamente de moléculas de água (isto é, a sua própria). Como substância pura tem sempre uma composição constante. Assim, cada molécula de água é constituído por dois átomos de hidrogénio e um átomo de oxigénio.
As propriedades de substâncias puras, ao contrário de misturas de caráter permanente e mudança aparência quando impurezas. Só água destilada tem um ponto de ebulição e guiné entra em ebulição a uma temperatura mais elevada. Deve-se ter em mente que qualquer substância pura não é absolutamente claro, porque mesmo alumínio puro tem uma impureza na composição, embora tenha uma quota de 0,001%. Surge a pergunta: como descobrir a massa de substância pura? A fórmula para o cálculo é como se segue: – m (massa) da substância pura = W (concentração) da mistura de substância pura * / 100%.
Há também um tipo de substâncias puras tais como substâncias altamente purificadas (ultra-pura, de alta pureza). Esses materiais são usados na produção de semicondutores em uma variedade de dispositivos de medição e computação, energia nuclear e em muitos outros campos profissionais.

Exemplos de substâncias puras
Descobrimos que uma substância pura é que ele contém elementos de uma espécie. Um bom exemplo de uma substância pura pode servir como uma neve. Na verdade, é a mesma água, mas em contraste com a de água, o que nos deparamos todos os dias, a água é muito mais limpo e não contém impurezas. O diamante é também uma substância pura, uma vez que contém apenas carbono, sem impurezas. É igualmente aplicável aos cristal de rocha. Numa base diária, são confrontados com ainda outro exemplo de material puro – açúcar refinado, que contém apenas uma sacarose.
misturas
Já vimos exemplos de substâncias puras e substâncias puras, agora passar para uma outra categoria de substâncias – misturas. A mistura – quando várias substâncias são misturados uns com os outros. Somos confrontados com as misturas em uma base regular, mesmo em casa. A mesma solução de chá ou sabonete é uma mistura que utilizar numa base diária. As misturas podem ser criados pela pessoa, e pode ser natural. Eles são sólido, líquido e gasoso. Como mencionado acima, o mesmo chá é uma mistura de água, açúcar e o chá. Este é um exemplo de mistura criada pelo homem. O leite é uma mistura natural, tal como aparece, sem intervenção humana no processo de desenvolvimento e contém muitos componentes diferentes.

Uma mistura de homem-quase sempre longa duração e natural sob a influência de calor começam a desintegrar-se em partículas individuais (de leite, por exemplo, azeda em poucos dias). Misturas também são divididos em heterogênea e homogênea. misturas heterogéneas são heterogéneas, e os seus componentes visível a olho nu e ao microscópio. Estas misturas são referidas como suspensões, que são por sua vez dividido pela suspensão (a substância sólida e a substância no estado líquido) e em emulsão (duas substâncias no estado líquido). A mistura homogénea homogénea, e os seus componentes individuais não pode ser considerado. Eles são também referidos como soluções (substâncias podem estar na forma gasosa, líquida ou de estado sólido).
Características e misturas de substâncias puras
Por conveniência, a informação é apresentada em forma de tabela.
|
sinal comparativa |
substâncias limpas |
misturas |
|
A composição das substâncias |
Reter pessoal permanente |
Possui uma estrutura instável |
|
tipos de substâncias |
Contém uma substância |
Eles incluem várias substâncias |
|
Propriedades físicas |
Manter as propriedades físicas constantes |
Tenha um propriedades físicas não-permanentes |
|
Mudando a energia da substância |
Mudanças na formação de energia |
não muda |
Métodos para obtenção das substâncias puras
Na natureza, há muitas substâncias na forma de misturas. Eles são usados em farmacologia e produção industrial.
No caso das substâncias puras são vários métodos de separação. A mistura heterogénea é dividido por decantação e filtração. As misturas homogéneas são divididos por meio de evaporação e destilação. Considere cada método separadamente.
liquidação
Este método é usado para a separação de suspensões, tais como uma mistura de areia de rio com água. O principal princípio em que se baseia processo de sedimentação, é a diferença em densidades das substâncias a ser separadas. Por exemplo, uma substância dura e água. Que são mais pesados do que a água pura? Esta areia, por exemplo, que em virtude de sua massa vai começar a se depositar no fundo. Da mesma forma emulsões diferentes separadas. Por exemplo, a água pode ser separada do óleo vegetal ou óleo. Estas substâncias no processo de separação formar uma pequena película de água na superfície. Sob condições laboratoriais, o mesmo processo é levado a cabo usando um funil de separação. Este método de misturas que separam trabalha na natureza (sem intervenção humana). Por exemplo, a deposição de fuligem e fumaça de se estabelecer o creme de leite.
filtragem
Este método é adequado para a obtenção de substâncias puras a partir de misturas heterogéneas, por exemplo, misturas de água com sal comum. Então, como a filtragem funciona no processo de separação de uma mistura de partículas? O resultado final é que as substâncias são diferentes níveis de solubilidade e de tamanho de partícula.
O filtro é concebido de modo que pudesse passar através de apenas as partículas com a mesma ou a solubilidade do mesmo tamanho que pode ser ignorada. partículas inadequadas maiores e outros não podem passar através do filtro e vai ser rastreada. O papel do filtro pode jogar não apenas os dispositivos e soluções especializadas dentro do laboratório, mas também todas as coisas familiares, como a lã, carvão, argila calcinada, vidro prensado e outros objetos porosos. Os filtros são usados na vida real é muito mais comum do que parece.
De acordo com este princípio funciona para todos nós aspirador familiar, o que separa grandes partículas de poeira e habilmente chama pequena, incapaz de danificar o mecanismo. Quando você está doente, então você colocar em uma atadura de gaze, que pode filtrar as bactérias. Trabalhadores cuja ocupação está associada com a propagação de gases perigosos e poeira, usar máscaras para protegê-los de envenenamento.
O impacto do ímã e água
Desta forma é possível separar uma mistura de pó de ferro e enxofre. O princípio da separação baseia-se nos efeitos de um ímã sobre o ferro. partículas de ferro são atraídas a um íman, ao passo que o enxofre irá permanecer no lugar. O mesmo método pode ser utilizado para separar outras partes metálicas do peso total dos diferentes materiais.
Se o enxofre em pó é misturada com pó de ferro, verter em água, partículas de enxofre não molhável flutuar à superfície da água, enquanto o ferro se encontram imediatamente pesado na parte inferior.
A evaporação e cristalização
Este método funciona com uma mistura homogénea, tal como sais dissolvidos na água. Ele funciona em processos naturais e condições de laboratório. Por exemplo, certos água do lago foi evaporado sob aquecimento, e o sal permanece no seu lugar. Do ponto de vista químico, este processo baseia-se no fato de que a diferença entre as duas substâncias em ebulição impede evaporar simultaneamente. água consumida irá transformar-se em vapor, e o sal remanescente irá permanecer no seu estado normal.
Se a substância a ser extraída (açúcar, por exemplo) são fundidos por meio de aquecimento, a água não é evaporado completamente. A mistura é aquecida em primeiro lugar e, em seguida, a mistura resultante foi modificado insistir partículas de açúcar assente na parte inferior. Às vezes é mais difícil – separação de substâncias com um ponto de ebulição elevado. Por exemplo, a separação de água a partir do sal. Neste caso, o material vaporizado para ser recolhido, arrefecer e condensar. Este método é chamado a separação de misturas homogéneas por destilação (ou destilação). Existem dispositivos especiais que água destilada. Tal água (destilada) é amplamente utilizado em farmacologia ou em sistemas de arrefecimento de automóveis. Claro, o mesmo método de pessoas estão destilada álcool.

cromatografia
O último método é a separação – cromatografia. Ele é baseado no fato de que alguns materiais tendem a absorver outras substâncias ingredientes. Ele funciona da seguinte forma. Se você pegar um pedaço de papel ou um pano, em que algo está escrito em tinta e submergir parte da água, você vai notar o seguinte: A água começará a papel absorvente ou pano, e vai subir, mas o corante será um pouco para trás. Usando esta técnica MS cientista cor poderia separar a clorofila (a substância que dá plantas cor verde) a partir das partes verdes da planta.
















