A partir do período antigo para o meio do século 18, a ciência foi dominado pela noção de que o átomo – uma partícula de matéria que não pode ser dividido. Inglês cientista e naturalista, e D. Dalton deu uma definição do átomo como a menor parte de um elemento químico. MV Lomonosov na sua doutrina atómica e molecular era capaz de dar uma definição do átomo e molécula. Ele estava convencido de que a molécula, o que ele chamou de "corpúsculos", composto por "elementos" – átomos – e estão em constante movimento.
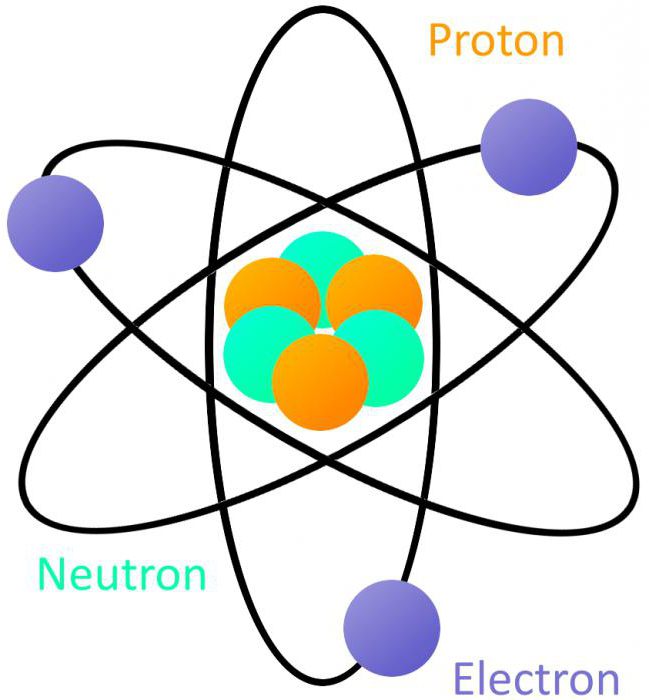
D. I. Mendeleev acreditava que este substâncias subunidades que compõem o mundo material, mantém todas as suas propriedades somente se ele não está sujeita a divisão. Neste artigo, que definem um objecto como um microcosmos do átomo, e estudar as suas propriedades.
Fundo da teoria da estrutura atômica
No século 19, é amplamente reconhecida como a declaração sobre a indivisibilidade do átomo. A maioria dos cientistas acreditam que as partículas de um elemento químico sob quaisquer circunstâncias não pode ser transformado em átomos de outros elementos. Essas idéias foram a base sobre a qual foi baseada a definição de um átomo até 1932. No final do século 19 na ciência foram feitas descobertas fundamentais que mudaram essa visão. Em primeiro lugar, em 1897, o físico britânico Joseph John Thomson descobriu o elétron. Este fato é fundamentalmente mudou as ideias dos cientistas sobre parte indivisível do elemento químico.
Como provar que a estrutura complexa átomo
Mesmo antes da descoberta do elétron , os cientistas concordam unanimemente que os átomos não têm carga. Em seguida, verificou-se que os electrões são facilmente distinguidos a partir de qualquer elemento químico desejado. Eles podem ser encontrados em uma chama, eles são portadores de corrente elétrica, eles liberam substâncias durante a radiação de raios-x.

Mas se os elétrons fazem parte de todos, sem exceção, e átomos carregados negativamente, assim, em um átomo existem algumas partículas que são a certeza de ter uma carga positiva, caso contrário, os átomos não seria eletricamente neutro. Para ajudar a revelar a estrutura do átomo ajudou um fenómeno físico como radioactividade. Ele deu a definição correta do átomo na física, e depois química.
Os raios invisíveis
Francês físico A. Becquerel foi o primeiro a descrever o fenómeno de emissão de átomos de alguns elementos químicos, visualmente raios invisíveis. Eles ionizar o ar passe através do material, fazendo com que o enegrecimento de chapas fotográficas. Mais tarde, os Curie e Rutherford descobriram que substâncias radioactivas são transformados em átomos de outros elementos químicos (tais como o urânio – neptúnio).
radiação radioactiva é não uniforme em composição: partículas alfa, partulas beta, raios gama. Assim, o fenómeno de radioactividade mostrou que a tabela periódica dos elementos partículas têm uma estrutura complexa. Este fato fez com que as alterações feitas na definição do átomo. O que partículas é um átomo, dada pelo Rutherford obteve novos fatos científicos? A resposta a esta questão foi o modelo proposto estudante nuclear do átomo, de acordo com a qual os electrões em torno do núcleo de carga positiva mover.
modelo contradições Rutherford
A teoria do cientista, apesar do seu carácter excepcional, não podia definir objetivamente o átomo. Seus resultados foram contrários às leis fundamentais da termodinâmica, segundo a qual todos os elétrons que orbitam os núcleos perdem sua energia e, como pode ser, mais cedo ou mais tarde terá de cair sobre ele. Atom neste caso destruído. Isso não é realmente o caso, uma vez que os produtos químicos e partículas de que são feitas, existe na natureza por um longo tempo. Inexplicavelmente átomo tal determinação com base na teoria de Rutherford, bem como o fenómeno que ocorre quando passa substâncias simples quentes através de uma rede de difracção. Após espectros atómica formados ao mesmo tempo ter uma forma linear. Este conflito com o modelo de Rutherford do átomo, de acordo com o qual o espectro teria de ser contínuo. De acordo com os conceitos da mecânica quântica, electrões presentes no núcleo não são caracterizados como objectos pontuais, assim como com a forma da nuvem de electrões.

A maior parte da sua densidade de um determinado local de espaço em torno do núcleo, e é considerada como sendo a localização de uma partícula num dado momento. Além disso, verificou-se que o átomo, os electrões são dispostas em camadas. O número de camadas pode ser determinada pelo conhecimento do número do período em que o elemento em D. I. Sistema Mendeleeva Periódica. Por exemplo, o átomo de fósforo contém 15 elétrons e tem três níveis de energia. O indicador, que determina o número de níveis de energia é chamado o número quântico principal.
Estabeleceu-se experimentalmente que o nível de energia de elétrons, localizado mais próximo ao núcleo, tem a energia mais baixa. Cada shell de energia é dividido em sub-níveis, e eles, por sua vez, sobre os orbitais. Os electrões são localizados em diferentes orbitais têm os mesmos formam as nuvens (s, p, d, f).
Com base no acima exposto, conclui-se que a forma da nuvem de electrões não pode ser arbitrária. É expressamente determinada de acordo com a orbital número quântico. Nós também acrescentar que o estado do elétron para as partículas também é determinado por dois valores – magnético e número quântico de spin. A primeira é baseada na equação de Schrödinger e caracteriza a orientação espacial da nuvem de elétrons em função da tridimensionalidade do nosso mundo. O segundo indicador – o número de rotação sobre ele determinar a rotação do elétron em torno de seu eixo ou anti-horário.
A descoberta do neutrão
Através do trabalho de D. Chadwick, realizou-los em 1932, foi dada uma nova definição do átomo em química e física. Em seus experimentos científicos, ele provou que na clivagem ocorre radiação polônio causado pelas partículas sem carga, a massa 1,008665. Uma nova partícula elementar foi nomeado o nêutron. Sua descoberta e estudo de suas propriedades permitiu que os cientistas soviéticos V. Gapon e Ivanenko criar uma nova teoria da estrutura do núcleo atômico, contendo prótons e nêutrons.
De acordo com a nova teoria, determinando a substância tinha a seguinte átomo de formar uma unidade estrutural do elemento químico, que consiste de um núcleo contendo protões, neutrões e electrões que se deslocam em torno dele. O número de partículas positivas no núcleo é sempre igual ao número ordinal do elemento químico no sistema periódico.
Mais tarde Professor Zhdanov em seus experimentos confirmaram que sob a influência da radiação cósmica duro, núcleos atômicos são divididos em prótons e nêutrons. Além disso, ficou provado que as forças que mantêm estas partículas elementares no núcleo, é extremamente intensiva de energia. Eles atuam em distâncias muito curtas (da ordem de 10 -23 cm), chamado nucleares. Como mencionado anteriormente, por MV Lomonosov foi capaz de dar uma definição do átomo e da molécula com base em fatos científicos conhecidos por ele.

Atualmente reconhecido considere o seguinte modelo: átomo consiste de um núcleo e elétrons movendo-se em torno dele em um caminhos estritamente definidas – orbitais. Electrões, ao mesmo tempo exibem as propriedades de ambas as partículas e das ondas, isto é, tem uma natureza dupla. O núcleo de um átomo é concentrada quase toda a sua massa. Ele consiste de prótons e nêutrons associadas às forças nucleares.
Se é possível pesar átomo
Acontece que cada átomo tem massa. Por exemplo, é de hidrogênio 1,67h10 -24 foi mesmo difícil imaginar quão pequeno este valor. Para encontrar o peso do objecto, não utilize as escalas e o oscilador, que é um nanotubo de carbono. Para calcular o peso do átomo e a molécula mais quantidade conveniente é o peso relativo. Ele mostra quantas vezes o peso de uma molécula ou de um átomo de mais do que 1/12 do átomo de carbono, que é 1,66h10 -27 kg. massas atómicas relativas são apresentados na Tabela Periódica dos elementos químicos, e que eles não têm qualquer dimensão.
Os cientistas sabem muito bem que o peso atômico de um elemento químico – é o número de massa média de isótopos. Parece, na natureza de uma unidade de um elemento químico pode ter massas diferentes. Assim, as cargas dos núcleos de partícula tal estrutural mesmos.
Os cientistas descobriram que os isótopos diferem no número de neutrões no núcleo e núcleos carregá-los idênticos. Por exemplo, um átomo de cloro, com uma massa de 35 continha 18 neutrões e 17 protões, e com uma massa de 37 – 20 protões e 17 neutrões. Muitos elementos químicos são misturas de isótopos. Por exemplo, as substâncias simples, tais como potássio, árgon, oxigénio contido nos seus átomos de composição que representa três isótopo diferente.
Determinação de atomicidade
Ele tem várias interpretações. Considere o que se entende por este termo em química. Se os átomos de um elemento químico pode, pelo menos momentaneamente existem isoladamente, não tende a formar partículas mais complexas – moléculas, em seguida, dizemos que essas substâncias têm uma estrutura atómica. Por exemplo, em várias fases da reacção de cloração do metano. É amplamente utilizado em química orgânica sintética para os principais derivados de halogénio: diclorometano, tetracloreto de carbono. -Se separar as moléculas de cloro para átomos que possuem uma elevada reactividade. Eles destruir ligações sigma na molécula de metano, proporcionando uma reacção de substituição da cadeia.
Outro exemplo de um processo químico que tem grande importância na indústria – a utilização de peróxido de hidrogénio como um agente desinfectante e de branqueamento. Determinação de oxigénio atómico como um produto de clivagem de peróxido de hidrogénio ocorre em ambas as células vivas (pela enzima catalase), e no laboratório. O oxigénio atómico qualitativamente determinado pelas suas elevadas propriedades antioxidantes e sua capacidade para destruir agentes patogénicos: bactérias, fungos e seus esporos.

Como o envelope nuclear
Encontraram-se anteriormente que a unidade estrutural de um elemento químico tem uma estrutura complexa. Em torno das partículas de núcleo com carga positiva giram electrões negativos. O Prémio Nobel Niels Bohr, com base na teoria quântica da luz, criado um ensinamento, na qual a caracterização e identificação de átomos são como se segue: electrões se deslocam em torno do núcleo apenas em determinados percursos fixos neste caso não irradiam energia. Bohr, os cientistas mostraram que as partículas do microcosmo, que incluem átomos e moléculas não obedecem as leis válidas para grandes corpos – objetos macrocosmo.
A estrutura das camadas eletrônicas de partículas foi estudado em artigos sobre cientistas de física quântica, como Hund, Pauli Klechkovskii. Desde que se tornou conhecido que os elétrons fazem o movimento de rotação em torno do núcleo não é caótico, mas em certos caminhos fixos. Pauli descobriu que dentro de um único nível de energia em cada uma das suas orbitais s, p, d, f em células electrónicas pode ser não mais de duas partículas carregadas negativamente de valor de rotação oposto + ½ e – ½.
regra de Hund explicou como preencher orbitais de elétrons com o mesmo nível de energia.
aufbau princípio, também chamada regra n + l, explicar como orbitais cheios multielectron átomos de elementos (5, 6, 7 ciclos). Todas as regularidades acima serviu de base teórica de elementos químicos criados por Dmitriem Mendeleevym.
grau de oxidação
É um conceito fundamental em química e descreve o estado de um átomo em uma molécula. A moderna definição do grau de oxidação dos átomos é como se segue: a carga é condicionado átomos na molécula, que é calculado com base nos conceitos que uma molécula contém apenas a composição iónica.
A oxidação pode ser expressa por um número inteiro ou um número fraccionai, a valores positivos, negativos ou zero. Na maior parte dos átomos de elementos químicos têm vários estados de oxidação. Por exemplo, o azoto é -3, -2, 0, 1, 2, 3, 4, 5. Mas um tal elemento, tais como flúor, em todos os seus compostos tem apenas um estado de oxidação igual a -1. Se for apresentada uma substância simples, o seu estado de oxidação zero. Este quantidades químicos convenientes a utilizar para a classificação das substâncias e para descrever as suas propriedades. Na maioria dos casos, o grau de oxidação da química usada na criação de reacções equações redox.
As propriedades dos átomos
Graças às descobertas da física quântica, a definição moderna do átomo, que é baseado na teoria de Ivanenko e Gapon E, completada com os seguintes fatos científicos. A estrutura de um núcleo atómico não é alterada durante as reacções químicas. A mudança afeta apenas os orbitais de elétrons estacionários. A sua estrutura pode ser atribuída a uma série de propriedades físicas e químicas das substâncias. Se o electrão deixa uma órbita estacionária e prossegue para orbital com uma energia mais elevada, tais átomo é chamado animado.

Deve-se notar que os elétrons não pode ser um longo tempo sobre esses orbitais não-core. Retornando à sua órbita estacionária, o elétron emite o quantum de energia. O estudo de tais características das unidades estruturais de elementos químicos como afinidade electrónica, electronegatividade, energia de ionização, permitiu aos cientistas não só para definir o átomo como um microcosmos partícula essencial, mas também permitiu-lhes para explicar a capacidade de átomos para formar um estado molecular estável e energeticamente mais favorável da matéria, uma possível consequência de a criação de qualquer tipo de ligações químicas estáveis: iónicas, covalentes-polar e apolar, dadoraceitador (como espécies de ligação covalente) e m etallicheskoy. Este último determina as propriedades físicas e químicas mais importantes de metais.
Estabeleceu-se experimentalmente que o tamanho de um átomo pode variar. Tudo dependerá da molécula na qual está incluído. Através de raio-X de difracção de análise pode calcular a distância entre átomos de um composto químico, bem como aprender raio unidade de elemento estrutural. Possuir padrões de mudança de raios dos átomos contidos no período ou ao grupo de elementos químicos, é possível prever as suas propriedades físicas e químicas. Por exemplo, em períodos com o aumento do núcleo atómico cobrar sua diminuição raios ( "átomo de compressão"), e, portanto, enfraquecer as propriedades dos compostos metálicos, não metálicos e amplificado.
Assim, o conhecimento da estrutura do átomo pode determinar com precisão as propriedades físicas e químicas de todos os elementos incluídos no sistema periódico dos elementos.













