O ânodo e cátodo – o que é e como identificar?
Sobre o ânodo e cátodo da fonte de alimentação que você precisa saber aqueles que estão engajados em eletrônica práticas. O que e como é chamado? Por que isso? Será aprofundada a consideração do tema sob o ponto de vista não só de rádio amador, mas também química. A explicação mais popular é a seguinte: anodo – um eletrodo positivo e o cátodo – negativo. Infelizmente, isso nem sempre é verdade e incompleta. Para ser capaz de definir o ânodo e do cátodo, é necessário ter uma base teórica e saber isso como um sim. Vamos examinar este artigo.
anódio
 Referindo-se com GOST 15596-82, que está envolvida na químicos fontes de corrente. Estamos interessados em informações colocadas na terceira página. De acordo com GOST, o eléctrodo negativo da célula electroquímica é exactamente o ânodo. Isso é assim, sim! E por quê? O fato é que através dele a corrente elétrica vem do circuito externo para a própria fonte. Como você pode ver, não é tão fácil como parece à primeira vista. Pode ser aconselhável considerar cuidadosamente o quadro apresentado no artigo, se o conteúdo parece muito complicado – eles vão ajudar a entender o que o autor quer transmitir a você.
Referindo-se com GOST 15596-82, que está envolvida na químicos fontes de corrente. Estamos interessados em informações colocadas na terceira página. De acordo com GOST, o eléctrodo negativo da célula electroquímica é exactamente o ânodo. Isso é assim, sim! E por quê? O fato é que através dele a corrente elétrica vem do circuito externo para a própria fonte. Como você pode ver, não é tão fácil como parece à primeira vista. Pode ser aconselhável considerar cuidadosamente o quadro apresentado no artigo, se o conteúdo parece muito complicado – eles vão ajudar a entender o que o autor quer transmitir a você.
cátodo
Abordamos tudo ao mesmo GOST 15596-82. O eléctrodo positivo da célula electroquímica é que, na descarga a partir do qual sai para o circuito externo. Como você pode ver, os dados contidos no IEC 15596-82, ver a situação de uma posição diferente. Portanto, em consulta com os outros sobre certas estruturas precisa ser muito cuidadoso.
A ocorrência de termos
 Eles introduziram mais Faraday em janeiro de 1834, para evitar confusão e para alcançar uma maior precisão. Ele ofereceu sua própria versão, e lembrando o exemplo do sol. Então, ele tem um ânodo – está aumentando. Sol se move para cima (corrente entra). Cathode – está definido. O sol se põe (corrente em).
Eles introduziram mais Faraday em janeiro de 1834, para evitar confusão e para alcançar uma maior precisão. Ele ofereceu sua própria versão, e lembrando o exemplo do sol. Então, ele tem um ânodo – está aumentando. Sol se move para cima (corrente entra). Cathode – está definido. O sol se põe (corrente em).
EXEMPLO tubos de rádio e diodo
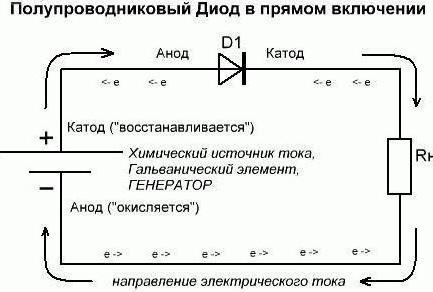
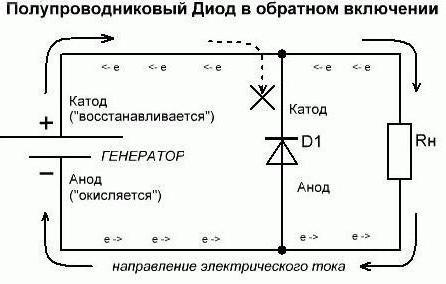 Continuamos a entender que para se referir ao que é usado. Suponha que um dos o poder que temos esses consumidores em um estado aberto (em directo). Assim, a partir do circuito externo por um diodo o elemento ânodo é corrente eléctrica. Mas não ser confundido devido à essa explicação da direção do elétron. Através do cátodo em um circuito externo de todos os anúncios elétricos saídas elemento atual. Uma situação que se desenvolveu hoje, lembra casos, quando as pessoas olham para o padrão invertido. Se os dados referem-se ao complexo – lembre-se que para compreendê-los desta forma necessariamente de forma exclusiva para os químicos. E agora vamos fazer a inclusão inversa. Pode-se notar que os diodos semicondutores praticamente não vai conduzir corrente. A única exceção possível aqui – os elementos de decomposição reversa. Um diodo de vácuo (kenotron, rádio) geralmente não conduzir a corrente inversa. Portanto, considera-(arbitrariamente) que ele não passar por eles. Portanto, as conclusões formais no ânodo de diodo e cátodo não desempenhar as suas funções.
Continuamos a entender que para se referir ao que é usado. Suponha que um dos o poder que temos esses consumidores em um estado aberto (em directo). Assim, a partir do circuito externo por um diodo o elemento ânodo é corrente eléctrica. Mas não ser confundido devido à essa explicação da direção do elétron. Através do cátodo em um circuito externo de todos os anúncios elétricos saídas elemento atual. Uma situação que se desenvolveu hoje, lembra casos, quando as pessoas olham para o padrão invertido. Se os dados referem-se ao complexo – lembre-se que para compreendê-los desta forma necessariamente de forma exclusiva para os químicos. E agora vamos fazer a inclusão inversa. Pode-se notar que os diodos semicondutores praticamente não vai conduzir corrente. A única exceção possível aqui – os elementos de decomposição reversa. Um diodo de vácuo (kenotron, rádio) geralmente não conduzir a corrente inversa. Portanto, considera-(arbitrariamente) que ele não passar por eles. Portanto, as conclusões formais no ânodo de diodo e cátodo não desempenhar as suas funções.
Por que há confusão?
Especificamente, a fim de facilitar a aprendizagem e aplicação prática, foi decidido que os elementos de nomes de terminais de diodo não vai mudar, independentemente do seu tipo de conexão, e eles vão ser "ligada" aos achados físicos. Mas isso não se aplica a baterias. Assim, nos diodos semicondutores tudo depende do tipo de condutividade do cristal. Os tubos de vácuo que questão é ligado a um eléctrodo, que emite electrões em vez do arranjo de filamentos. Claro que, aqui há algumas nuances: por exemplo, através de tais dispositivos semicondutores, como um supressor e um díodo Zener pode ser um pequeno fluxo de corrente inversa, mas aqui não são específicos, claramente para além do âmbito deste artigo.
Investigada com acumulador elétrico
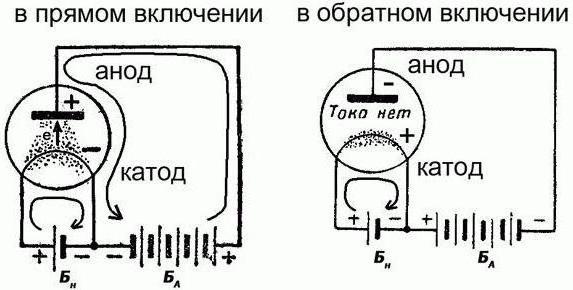 Este é verdadeiramente um exemplo clássico de uma fonte química de corrente elétrica, que é renovável. A bateria está em um dos dois modos: a carga / descarga. Em ambos os casos será diferente direção da corrente elétrica. Mas note-se que a polaridade dos eléctrodos, ao mesmo tempo não vai mudar. E eles podem atuar em diferentes funções:
Este é verdadeiramente um exemplo clássico de uma fonte química de corrente elétrica, que é renovável. A bateria está em um dos dois modos: a carga / descarga. Em ambos os casos será diferente direção da corrente elétrica. Mas note-se que a polaridade dos eléctrodos, ao mesmo tempo não vai mudar. E eles podem atuar em diferentes funções:
- Durante o carregamento, o eletrodo positivo aceita a corrente elétrica e um ânodo, e seu negativo e libera o chamado cátodo.
- Na ausência de movimento sobre eles para conduzir uma conversa não faz sentido.
- Durante a descarga do eléctrodo positivo liberta uma corrente eléctrica e um cátodo, e o negativo recebe e é chamado o ânodo.
Em Eletroquímica Say a Word
Ele usa uma definição ligeiramente diferente. Deste modo, o ânodo é considerado como um eléctrodo, onde os processos de oxidação ocorrem. E curso de escola lembrança da química, você pode responder o que está acontecendo do outro lado? O eléctrodo no qual os processos de recuperação, chamado o cátodo. Mas não há nenhuma referência aos dispositivos eletrônicos. Vamos olhar para o valor das reações de oxidação-redução para nós:
- Oxidação. Existe um processo de retorno de uma partícula de electrões. Neutra se transforma em um ião positivo, e a negativa é neutralizada.
- Recuperação. O processo de obtenção de uma partícula de electrões. transformado positivo em um íon neutro, e depois para negativo na iteração.
- Os dois processos são interdependentes (por exemplo, o número de electrões que é igual dadas ADJOINT seu número).
Faraday também para indicar foram introduzidos os nomes para os elementos que fazem parte de reações químicas:
- Cátions. Os chamados iões carregados positivamente que se movem na solução de electrólito para o pólo negativo (cátodo).
- Ânions. Assim, eles chamado iões negativos que se movem na solução de electrólito no polo positivo (ânodo).
Como as reações químicas ocorrem?
 Oxidação e redução meias-reacções são separados no espaço. A transição de electrões entre o cátodo e o ânodo é realizada não directamente, mas através de um condutor de circuito externo, o que cria uma corrente eléctrica. Aqui pode ser observado interconversão de formas químicas e elétricas de energia. Por conseguinte, para formar um sistema de circuito externo dos condutores de vários tipos (que é o que os eléctrodos no electrólito), e é necessária a utilização de metal. Veja-se, a tensão entre o ânodo e cátodo existe como uma advertência. E se não havia nenhum elemento que impede diretamente para fazer o processo necessário, o valor das fontes atuais químicos seria muito baixo. E assim, graças ao fato de que a carga é necessário caminhar sobre o esquema, recolhidas e trabalhou como técnico.
Oxidação e redução meias-reacções são separados no espaço. A transição de electrões entre o cátodo e o ânodo é realizada não directamente, mas através de um condutor de circuito externo, o que cria uma corrente eléctrica. Aqui pode ser observado interconversão de formas químicas e elétricas de energia. Por conseguinte, para formar um sistema de circuito externo dos condutores de vários tipos (que é o que os eléctrodos no electrólito), e é necessária a utilização de metal. Veja-se, a tensão entre o ânodo e cátodo existe como uma advertência. E se não havia nenhum elemento que impede diretamente para fazer o processo necessário, o valor das fontes atuais químicos seria muito baixo. E assim, graças ao fato de que a carga é necessário caminhar sobre o esquema, recolhidas e trabalhou como técnico.
O que é: Passo 1
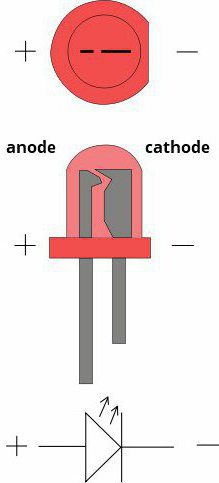
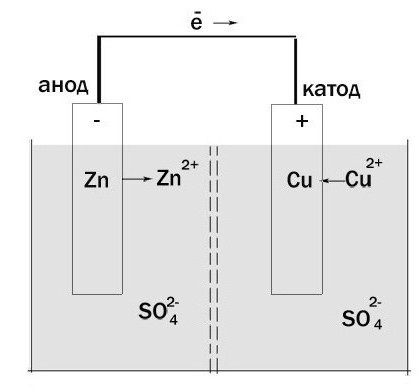 Agora vamos determinar qual é qual. Dê uma galvânica células-Jacobi Daniel. Por um lado, é constituído pelo eléctrodo de zinco, que é imerso numa solução de sulfato de zinco. Em seguida, há uma barreira porosa. E por outro lado, tem um eléctrodo de cobre, que está disposto numa solução de sulfato de cobre. Eles estão em contato uns com os outros, mas características químicas e do septo não dão misturam.
Agora vamos determinar qual é qual. Dê uma galvânica células-Jacobi Daniel. Por um lado, é constituído pelo eléctrodo de zinco, que é imerso numa solução de sulfato de zinco. Em seguida, há uma barreira porosa. E por outro lado, tem um eléctrodo de cobre, que está disposto numa solução de sulfato de cobre. Eles estão em contato uns com os outros, mas características químicas e do septo não dão misturam.
Passo 2: Processo
oxidação de zinco ocorre e os electrões se movem através de um circuito externo de cobre. Assim, verifica-se que a célula eletroquímica tem um ânodo, carregada negativamente, e o cátodo – o positivo. Além disso, este processo só pode ter lugar nos casos em que os elétrons é onde "ir". O fato é que, para obter diretamente a partir do eletrodo para o outro impede a existência de "isolamento".
Passo 3: A electrólise
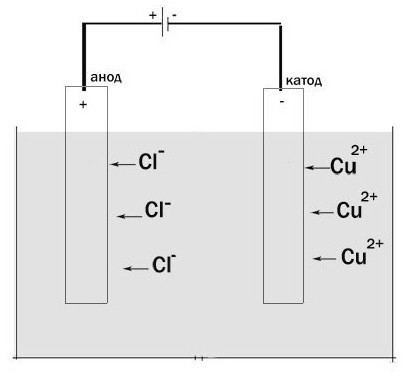 Vamos olhar para o processo de eletrólise. Instalação para a sua passagem é um vaso, no qual existe uma solução de electrólito ou derreter. O eléctrodo tem duas omitido. Eles estão conectados a uma fonte de energia DC. O ânodo neste caso – é o eléctrodo que é ligado ao polo positivo. Aqui é oxidado. Um eletrodo de carga negativa – o cátodo é. Aqui, uma reação de redução ocorre.
Vamos olhar para o processo de eletrólise. Instalação para a sua passagem é um vaso, no qual existe uma solução de electrólito ou derreter. O eléctrodo tem duas omitido. Eles estão conectados a uma fonte de energia DC. O ânodo neste caso – é o eléctrodo que é ligado ao polo positivo. Aqui é oxidado. Um eletrodo de carga negativa – o cátodo é. Aqui, uma reação de redução ocorre.
Passo 4: Finalmente
Portanto, quando se opera estes conceitos deve sempre ter-se em mente que o ânodo não está em 100% dos casos usado para designar um eléctrodo negativo. Além disso, o cátodo intermitentemente pode perder a sua carga positiva. Tudo depende de que tipo de processo ocorre no eletrodo: a redução ou oxidação.
conclusão
Isso é tudo isto é – não muito difícil, mas não se pode dizer que simples. Nós consideramos uma célula galvânica, o ânodo e cátodo em termos do regime, e agora os problemas com a conexão com o tempo de funcionamento da fonte de alimentação não deve ser. E, finalmente, você precisa sair um pouco mais valioso para você informações. Sempre tem em mente a diferença, que tem o potencial do cátodo / o potencial do ânodo. O fato de que o primeiro será sempre um pouco grande. Isto é devido ao fato de que a eficiência não funciona com a figura de 100% e uma parte da carga é dissipada. É por causa disso você pode ver que as baterias têm um limite no número de vezes de carga e descarga.