Propriedades físicas e químicas do enxofre
Enxofre – bastante comum em elemento de natureza química (conteúdo XVI na crosta terrestre eo sexto – em águas naturais). Existem ambos enxofre nativo (livre elemento de estado) e as suas ligações.

Enxofre na natureza
Entre os minerais de enxofre natural mais importante pode ser chamado pirita de ferro, sphalerite, galena, cinábrio, stibnite. Os oceanos continha principalmente sob a forma de sulfato de cálcio, de magnésio e de sódio causando a rigidez das águas naturais.
Como chegar enxofre?
A extracção de minério de enxofre produzido por diferentes métodos. O principal método de enxofre é a sua fundição directamente in situ.
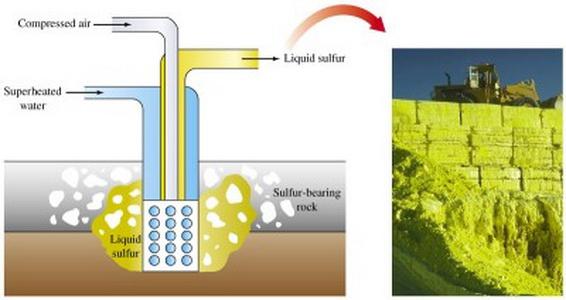
método de mineração aberta envolve o uso de escavadoras, remoção de camadas de estéril que cobrem minério sulfúrico. Após esmagamento, as rajadas de costura minério dirigidos para a sua planta seroplavilny.
Na indústria, o enxofre é obtido como subproduto dos processos em fornos para a fusão, a refinação. Em grandes quantidades, está presente no gás natural (sob a forma de dióxido de enxofre ou de sulfureto de hidrogénio), a extracção da qual é depositado sobre as paredes do equipamento utilizado. gás aprisionado a partir de enxofre é usado na indústria de química fina, como matérias-primas para a produção de vários produtos.
Este material pode ser preparado a partir de dióxido de enxofre e naturais. Para fazer isso, use o método Noel. Ela consiste na aplicação de "poços" de enxofre em que não há uma desgaseificação de enxofre. O resultado é um enxofre modificados são amplamente utilizados na produção de asfalto.
enxofre modificação alotrópica Básico
Enxofre allotropy inerente. Um grande número de modificações alotrópicas. O mais famoso são o ortorrômbica (cristalino), monoclínica (agulha) e enxofre plástico. As duas primeiras modificações são estáveis, o terceiro durante a solidificação é convertido num rômbico.

As propriedades físicas que caracterizam enxofre
Moléculas de ortorrômbica (α-S) e monoclínica (P-S) conter modificações a 8 átomos de enxofre, que estão ligados num circuito fechado por ligaes covalentes simples.
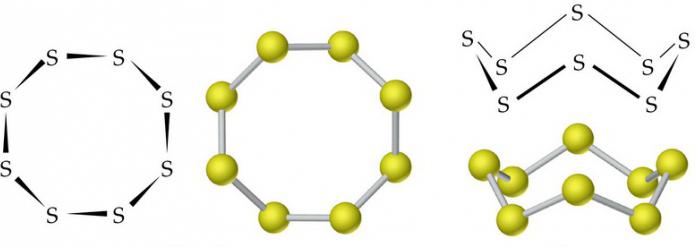
Sob condições normais, o enxofre tem uma modificação rômbico. É um sólido com uma densidade de 2,07 g / cm3 cristalino amarelo. É funde a 113 ° C. densidade de enxofre monoclínico é 1,96 g / cm3, a sua temperatura de fusão é de 119,3 ° C.
Após a fusão aumenta enxofre em volume e se torna líquido amarelo, o qual torna-se castanho a 160 ° C e convertida numa massa viscosa castanha escura ao atingir cerca de 190 ° C. A temperaturas superiores a este valor, a viscosidade diminui de enxofre. A cerca de 300 ° C que se torna de novo estado fluido líquido. Isto é porque no processo de aquecimento é polimerizado de enxofre, com o aumento da temperatura do aumento do comprimento da cadeia. E quando o valor da temperatura acima de 190 ° C, ocorre a destruição de unidades polimerizadas.

Depois de se arrefecer a massa fundida de enxofre formado naturalmente em cadinhos cilíndricos chamados fixo de enxofre – de cristais rômbicos de grandes dimensões, que tem uma forma distorcida de octaedros com parcialmente "cortar" bordas ou cantos.
Se o material em fusão é submetida a têmpera (por exemplo, através da utilização de água fria), é possível obter um enxofre plástico, é uma borracha castanha massa resiliente ou de cor vermelho escuro, com uma densidade de 2,046 g / cm 3. Esta modificação, ao contrário do ortorrômbica e monoclínica é instável. Gradualmente (durante várias horas), que muda de cor para amarelo, torna-se frágil e se transforma em um rhombic.
Quando a congelação do vapor de enxofre formas de azoto líquido (muito quente) purpurea sua modificação, que é estável a temperaturas abaixo de menos 80 ° C.
O meio aquoso é praticamente insolúvel enxofre. No entanto, caracteriza-se por uma boa solubilidade em solventes orgânicos. Mau condutor de eletricidade e calor.
O ponto de ebulição é enxofre 444,6 ° C. processo acompanhado pela libertação de fumos laranja-amarelo que consistem principalmente de S 8 moléculas que se dissociam por aquecimento subsequente, resultando na formação de equilíbrio de ebulição forma S 6, S e S 4 2. Além disso, quando aquecido decompõe moléculas grandes, e a uma temperatura acima de 900 graus pares consistem essencialmente em S 2 moléculas se dissociam em átomos a 1500 ° C.
O que tem propriedades químicas de enxofre?
O enxofre é um típico não-metal. Quimicamente activa. Oxidação – propriedades de redução de enxofre são mostrados em relação a uma pluralidade de elementos. Quando aquecido, pode ser facilmente conectado com quase todos os elementos, o que explica a sua presença obrigatória de minérios metálicos. A excepção é Pt, Au, I 2, N2 e gases raros. Oxidação que se manifesta em compostos de enxofre, -2, 4, 6.
Propriedades de enxofre e oxigénio causar o seu ar de combustão. O resultado desta interacção é a formação de dióxido de enxofre (SO 2) e de enxofre (SO 3) anidridos usadas para produzir ácidos sulfurosos e sulfúrico.
À temperatura ambiente, as propriedades de reduo de enxofre se manifestam apenas no que respeita a flúor na reacção que forma o hexafluoreto de enxofre :
- S + 2 3F = SF 6.
Depois do aquecimento (em uma massa fundida) é feito reagir com cloro, fósforo, silício, carbono. As reacções com o sulfureto de hidrogénio as formas de adição de hidrogénio sulfano combinado fórmula geral H 2 S H.
propriedades oxidativas observado enxofre por reacção com metais. Em alguns casos, pode-se observar uma reação bastante forte. A interacção de sulfuretos de metal formados (compostos de enxofre) e polissulfuretos (metais mnogosernistye).
aquecimento prolongado reagir com ácidos fortes, oxidantes, em que o oxidados.
Em seguida, considerar as propriedades básicas de compostos de enxofre.
dióxido de enxofre
óxido de enxofre (IV), também referido como o dióxido de enxofre e anidrido sulfuroso, é um gás (incolor) com um odor acentuado sufocação. Ele tende a ser liquefeitos sob pressão a temperatura ambiente. SO2 é um óxido acídico. Ele caracteriza-se por uma boa solubilidade em água. Isto cria um ácido fraco, instável sulfuroso, que só existe em solução aquosa. A reacção de dióxido de enxofre com sulfitos alcalinos formado.
Tem uma actividade química bastante elevado. A maioria dos pronunciada são as propriedades da redução química do óxido de enxofre (IV). Tais reacções são acompanhadas por um aumento no grau de oxidação do enxofre.
Propriedades químicas oxidantes manifestada óxido de enxofre na presença de agentes redutores fortes (por exemplo, monóxido de carbono).
trióxido de enxofre
O trióxido de enxofre (dióxido de enxofre) – o mais elevado de óxido de enxofre (VI). Sob condições normais, é um líquido volátil incolor com um odor sufocação. Ele tende a congelar a valores de temperatura inferiores a 16,9 graus. Neste caso, uma mistura de diferentes modificações cristalinas do trióxido de enxofre sólido. óxido de alto teor de enxofre propriedades higroscópicas causar a sua "dymlenie" nas condições de ar húmido. Como resultado, a formação de gotículas de ácido sulfúrico.
sulfureto de hidrogénio
O sulfureto de hidrogénio é um composto químico binário de hidrogénio e enxofre. H S 2 – é um gás incolor tóxico, as características da qual são sabor doce e cheiro de ovos podres. Ele derrete a uma temperatura de menos 86 ° C e ferve a -60 ° C. Termicamente instável. Em valores de temperatura superiores a 400 ° C provoca a decomposição do sulfureto de hidrogénio a S e H 2. Ele caracteriza-se por uma boa solubilidade em etanol. A água dissolve mal. Como resultado da dissolução em água forma de sulfureto de hidrogénio ácido fraco. O sulfureto de hidrogénio é um agente de redução forte.

Inflamável. No seu ar de combustão pode observar chama azul. Em concentrações elevadas pode reagir com muitos metais.
ácido sulfúrico
ácido sulfúrico (H 2 SO 4) pode ser de várias concentrações e pureza. O estado anidro é um líquido oleoso incolor com nenhum odor.
a temperatura à qual a substância é fundida, é de 10 ° C. ponto de ebulição é de 296 ° C. A água dissolve-se bem. Quando dissolvido sulfúrico hidratos de ácido são formados, com uma grande quantidade de calor. O ponto de ebulição das soluções aquosas a uma pressão de 760 mm Hg. Art. superior a 100 ° C. O aumento do ponto de ebulição ocorre com o aumento da concentração do ácido.
As propriedades de ácidos do material de aparecer na interacção com os óxidos básicos e bases. H 2 SO 4 é um diácido, assim, pode formar-se como sulfatos (meio de sais) e hidrossulfatos de (sal de ácido), a maioria das quais são solúveis em água.
Isto é mais claramente manifestado propriedades ácido sulfúrico em reacções redox. Isto é devido ao facto de que a composição de H 2 SO 4, ao mais alto grau de oxidação do enxofre (6). Como um exemplo de manifestações propriedades oxidativas de ácido sulfúrico pode resultar em reacção com o cobre:
- Cu + 2H 2 SO 4 = CuSO 4 + 2H 2 O + SO 2.
Enxofre: propriedades úteis
O enxofre é um elemento traço essencial para os organismos vivos. É uma parte dos aminoácidos (metionina e cisteína), enzimas e vitaminas. Este elemento está envolvido na formação da estrutura terciária da proteína. A quantidade de enxofre ligado quimicamente contida nas proteínas, é, em peso, 0,8-2,4%. O teor do elemento no corpo humano é de cerca de 2 gramas por 1 kg de peso (isto é, cerca de 0,2% de enxofre).
propriedades úteis do oligoelemento não pode ser superestimada. Protegendo o protoplasma de sangue, o enxofre é um assistente activo para o corpo na luta contra as bactérias nocivas. Depende da quantidade de coagulação, que é um elemento ajuda a manter o nível adequado. O enxofre também desempenha um papel na manutenção de níveis normais de concentração biliar produzido pelo corpo.
"A beleza mineral" muitas vezes é chamado, porque é absolutamente necessário para preservar a saúde da pele, cabelo e unhas. Enxofre capacidade inerente de proteger o corpo contra vários tipos de impacto ambiental negativo. Ela ajuda a retardar o processo de envelhecimento. Enxofre purifica o corpo de toxinas e protege da radiação, que é especialmente importante agora, dada a actual situação ambiental.
Quantidades insuficientes de oligoelementos no organismo pode levar a uma fraca remoção de toxinas, baixa imunidade e vitalidade.
Enxofre – um participante da fotossíntese bacteriana. É um componente da bacterioclorofila e sulfureto de hidrogénio – a fonte de hidrogénio.
Sera: propriedades e aplicações na indústria
O enxofre mais amplamente utilizado para produzir ácido sulfúrico. Também as propriedades deste material permitem a sua utilização para a vulcanização de borracha, como um fungicida na agricultura e até mesmo fármaco (colóide de enxofre). Além disso, o enxofre é utilizado para a produção de fósforos e composições de pirotecnia, que é uma parte para produzir as composições serobitumnyh seroasfalta.












