Catalase – uma enzima encontrada organismos em quase todos vivos. A sua função principal – para catalisar a decomposição do peróxido de hidrogénio em substâncias inofensivas para o organismo. A catalase é de grande importância para a vida das células, como os protege da destruição por espécies reactivas de oxigénio.
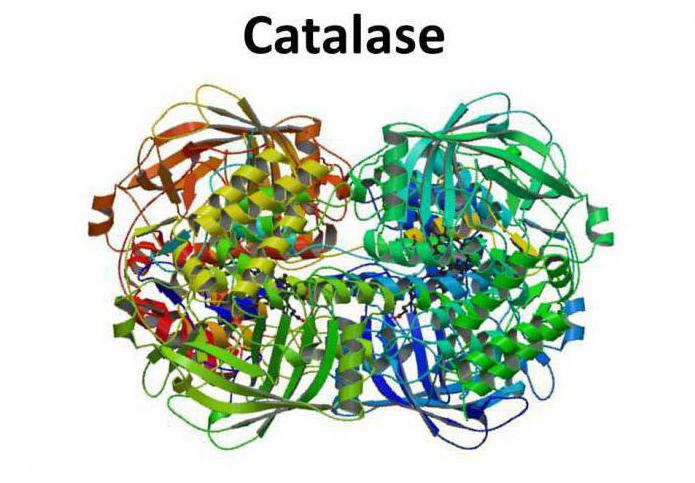
visão global
A enzima catalase refere-se a oxidorredutase – grande classe de enzimas que catalisam a transferência de electrões a partir da molécula de redução (dador) para a molécula de oxidante (aceitador).
O pH óptimo para a catalase no corpo humano é de cerca de 7, no entanto, a taxa de reacção não altera significativamente a valores do índice de hidrogénio 6,8-7,5. O pH óptimo para outros catalases que variam de 4 a 11, dependendo do tipo de organismo. A temperatura óptima também é diferente para uma pessoa é de cerca de 37 ° C
Catalase – uma das enzimas mais rápidos. Apenas uma molécula é capaz de converter os seus milhões de moléculas de peróxido de hidrogénio em água e oxigénio por segundo. Em termos de enzimologia que significa que um grande número de revoluções característicos da enzima catalase.
enzima estrutura
A catalase é um tetrâmero de quatro cadeias polipeptídicas, cada uma das quais tem mais do que 500 aminoidos de comprimento. A enzima é composta de quatro grupos de pórfiro heme, e através do qual reage com espécies de oxigénio activo. O grupo heme prostético oxidado é uma catalase.
História da descoberta
Catalase não era conhecido por cientistas 1818 anos até Louis Jacques Thénard químico descoberto em células de peróxido de hidrogênio vivendo não é sugerido que a sua destruição devido à ação de um material biológico desconhecido.

Em 1900, um químico alemão, Oskar Leo introduzido pela primeira vez o termo "catalase" para se referir a um peróxido substância em decomposição misteriosa. Ele foi capaz de responder à pergunta, onde a enzima catalase contido. Como resultado de inúmeras experiências Oskar Leo revelou que esta enzima é característica de quase todos os animais e plantas. Em células vivas, bem como muitas outras enzimas, a catalase está contida em peroxissomas.
Em 1937, ele foi o primeiro a se cristalizar catalase de fígado bovino. 250 kD – de peso molecular da enzima foi determinada em 1938. Em 1981, os cientistas receberam imagens de estrutura tridimensional de bovinos catalase.
A catálise de peróxido de hidrogénio
Apesar do facto de que o peróxido de hidrogénio – um produto de muitos processos metabólicos normais, não é inofensivo para o organismo.
 Para evitar a destruição de células e tecidos, o peróxido de hidrogénio deve ser rapidamente convertido em outro, menos perigoso para o corpo. É a este desafio e contende enzima catalase – se decompõe o peróxido a duas moléculas de moléculas de água e as moléculas de oxigénio.
Para evitar a destruição de células e tecidos, o peróxido de hidrogénio deve ser rapidamente convertido em outro, menos perigoso para o corpo. É a este desafio e contende enzima catalase – se decompõe o peróxido a duas moléculas de moléculas de água e as moléculas de oxigénio.
A reacção de decomposição do peróxido de hidrogénio em tecidos vivos:
2 H 2 O 2 → 2 H2O + O2
O mecanismo molecular da enzima de clivagem de peróxido de hidrogénio pela catalase não é ainda exactamente compreendido. Supõe-se que a reacção tem lugar em duas fases – a primeira etapa consiste em ferro catalase grupo prostético ligado a um átomo de oxigénio do peróxido, este gera uma molécula de água. No segundo passo, o heme oxidado interagir com uma outra molécula de peróxido de hidrogénio, formando-se assim uma outra molécula de água e uma molécula de oxigénio.
Através desta acção da enzima catalase para o peróxido de hidrogénio, na presença da substância activa nas amostras de tecido pode ser facilmente determinada. Para este adicionar suficiente para o teste da amostra de uma pequena quantidade de peróxido de hidrogénio e observar a reacção. A presença da enzima indica a formação de bolhas de oxigénio. Esta reação é bom porque não necessita de quaisquer ferramentas ou equipamentos especiais – que pode ser visto a olho nu.

Vale a pena notar que um ião de qualquer metal pesado pode agir como um inibidor não competitivo de catalase. Além disso, todos cianeto conhecidas comporta-se como um inibidor competitivo da catalase, se em muitos tecidos de peróxido de hidrogénio. Arsenatos actuam como activadores.
aplicação
Acção da enzima de catalase decompõe o peróxido de hidrogénio tem sido utilizado na indústria alimentar – utilizando esta enzima é removido do leite H 2 O 2 para a preparação de queijo. Outra aplicação – embalagem especial alimento que protege o produto contra a oxidação. A catalase é também utilizado na indústria têxtil para a remoção de peróxido de hidrogénio a partir de tecidos.
Ele é usado na higiene de lentes de contato em pequenas quantidades. Alguns desinfectantes são compostos de peróxido de hidrogénio e a catalase é utilizada para dividir este componente antes de reutilizar lentes.
atividade
Atividade da enzima catalase depende da idade do organismo. Os novos tecidos da actividade da enzima é muito maior do que na idade. Com a idade em humanos e em animais atividade catalase diminui gradualmente como resultado de envelhecimento de tecidos e órgãos.
De acordo com um estudo recente, uma diminuição da atividade da catalase é uma das possíveis causas de cabelos grisalhos. O peróxido de hidrogénio é produzido continuamente no corpo humano, mas nenhum dano – catalase decompõe rapidamente. Mas, se o nível de esta enzima é reduzida, é óbvio que nem todo o peróxido de hidrogénio é catalisada pela enzima. Assim, descora do interior do cabelo através da dissolução de corantes naturais. Esta descoberta inesperada actualmente a ser testado por pesquisadores, e pode desempenhar um papel no desenvolvimento de medicamentos, suspendendo envelhecimento dos cabelos.














