O estado de oxidação – este átomo elemento carga condicionada na molécula. Este conceito é fundamental em química inorgânica, sem o seu entendimento é impossível imaginar o processo de reações redox, tipos de ligações nas moléculas, propriedades químicas e físicas dos elementos. A fim de entender o que é o grau de oxidação é necessário primeiro entender o que se constitui átomo e como ele se comporta quando interagindo com seus pares. 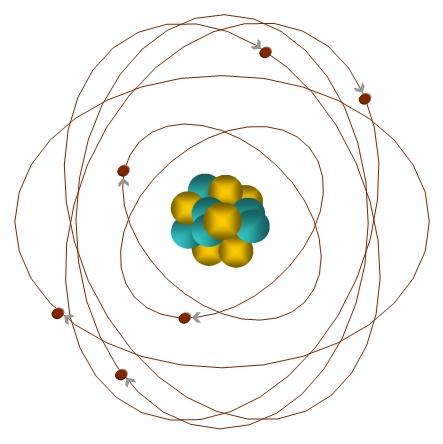
Como é sabido, o átomo consiste de protões, neutrões e electrões. Os protões e electrões, também chamados de núcleos, forma carregada positivamente núcleo electrões negativos giram em torno dele. A carga nuclear positivo é equilibrado global negativo carga dos elétrons. Consequentemente, o átomo neutro.
Cada elétron tem um certo nível de energia, o que determina a proximidade de sua localização para o núcleo: quanto mais próximo do núcleo – o menos energia. Eles estão dispostos em camadas. Os electrões de uma camada ter substancialmente a mesma forma nível de fornecimento de energia e de energia ou camada electrónica. Os electrões no exterior nível de energia não é muito fortemente ligados ao núcleo, de forma que possam participar em reacções químicas. Elementos que têm externamente de um a quatro elétrons em reações químicas, geralmente doar elétrons, e aqueles que têm de cinco a sete elétrons – tomar.
Há também elementos químicos chamados gases inertes, em que o nível de energia externa compreende oito electrões – a quantidade máxima possível. Eles praticamente não entram em reações químicas. Assim, qualquer átomo visa sua camada eletrônica externa "suplemento" para os necessários oito elétrons. Onde obter o que falta? Em outros átomos.  No processo de química elemento de reacção com maior electronegatividade "pega" electrões de um elemento com uma electronegatividade inferior. Electronegatividade elemento químico depende do número de electrões no nível de valência e a força da sua atracção para o núcleo. Um elemento, escolher-se os electrões, a carga negativa global torna-se maior do que a carga positiva do núcleo, enquanto a doar electrões – vice-versa. Por exemplo, em um composto de óxido de enxofre SO oxigénio tendo uma electronegatividade elevada, o enxofre leva os 2 electrões e adquire uma carga negativa, enquanto o enxofre permaneceu sem dois electrões obtém uma carga positiva. Neste caso, o grau de oxidação do oxigénio igual ao grau de oxidação do enxofre, tomado com o sinal oposto. O estado de oxidação é escrito no canto superior direito do elemento químico. Neste exemplo, como se segue: S 2 O -2.
No processo de química elemento de reacção com maior electronegatividade "pega" electrões de um elemento com uma electronegatividade inferior. Electronegatividade elemento químico depende do número de electrões no nível de valência e a força da sua atracção para o núcleo. Um elemento, escolher-se os electrões, a carga negativa global torna-se maior do que a carga positiva do núcleo, enquanto a doar electrões – vice-versa. Por exemplo, em um composto de óxido de enxofre SO oxigénio tendo uma electronegatividade elevada, o enxofre leva os 2 electrões e adquire uma carga negativa, enquanto o enxofre permaneceu sem dois electrões obtém uma carga positiva. Neste caso, o grau de oxidação do oxigénio igual ao grau de oxidação do enxofre, tomado com o sinal oposto. O estado de oxidação é escrito no canto superior direito do elemento químico. Neste exemplo, como se segue: S 2 O -2. 
O exemplo acima é relativamente simplista. Na verdade, os electrões exteriores de um átomo nunca é completamente transferido para o outro, eles tornam-se um "comum", portanto, o grau de oxidação dos elementos é sempre menor do que designado em livros de texto.
Mas, para simplificar a compreensão dos processos químicos deste fato é negligenciado.