hidróxido de sódio, soda cáustica ou – composto inorgânico que pertence a uma classe de bases ou hidróxidos. Também na técnica e no exterior desta substância chamada soda cáustica. Nome comum – soda cáustica – que era devido à sua forte ação corrosiva.
 Esta substância cristalina branca sólida tendo higroscopicidade, o qual funde a 328 graus. O hidróxido de sódio é prontamente solúvel em água e é um electrólito forte. Quando a dissociação rompe-se em um catião de metal e iões hidróxido.
Esta substância cristalina branca sólida tendo higroscopicidade, o qual funde a 328 graus. O hidróxido de sódio é prontamente solúvel em água e é um electrólito forte. Quando a dissociação rompe-se em um catião de metal e iões hidróxido.
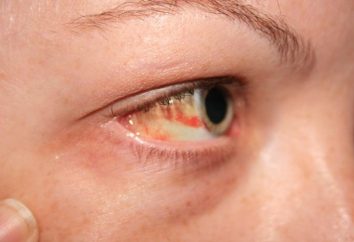
Após a dissolução em água forma o composto activo – alcalino – sensação ensaboada. Esta reacção processa-se muito rapidamente – com pulverizador e calor. Ele bateu cáustico na pele e nas mucosas provoca graves queimaduras químicas, então quando você trabalhar, você deve ter cuidado e proteger as mãos e os olhos. Após contacto com a substância para o epitélio ou os olhos, boca, é necessário logo que as áreas afectadas podem ser lavadas com água e uma solução fraca de ácido acético (2%) ou de boro (3%) do ácido, e, em seguida, novamente com água. Depois de fornecer ajuda de emergência para as vítimas precisam de ver um médico.
hidróxido de sódio (fórmula química do composto – NaOH, struturnaya – NaOH a) – uma substância química activa, que pode reagir com ambos inorgânico e de substâncias orgânicas. Detectá-lo nas soluções aquosas vai qualitativas reacção de ião hidróxido com uma variedade de indicadores. Assim, o indicador decisivo se torna azul escuro, alaranjado de metilo – amarelo, e fenolftaleína – framboesa, em que a intensidade da cor dependerá da concentração de álcali.
Gidrksid de sódio entrar em tal reacção: 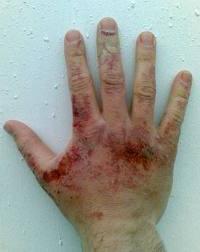
1. neutralização com ácidos, óxidos de ácido e compostos anfotéricos. O resultado desta reacção é a formação de água e gidroksokompleka sal ou – no caso de reacção com bases e os óxidos anfotéricos;
2. troca com sais;
3. com metais que estão na fila de hidrogénio Beketova elektorhimichesky e têm um baixo potencial;
4. Um não-metais e halogéneos;
4. ésteres de hidrólise;
5. saponificação com gorduras (formados sabão e glicerina);
6. reacção com álcoois (alcóxidos produzido substância).
Também na forma fundida soda cáustica pode destruir porcelana e de vidro, e a presença de oxigénio, – o metal nobre (platina).
O hidróxido de sódio pode ser preparada por métodos:
- electrólise de NaCl aquoso (diafragma e membrana método)
- química (cal e método de ferrite).
Nos últimos anos, os métodos mais comumente usados são baseados na eletrólise, porque eles são mais rentáveis.
A soda cáustica é muito popular e é usado em muitas indústrias – cosmético, papel e celulose, química, têxtil, alimentos. É usado como um aditivo E-524, para instalações de desgaseif i cação e na preparao de biodiesel.
Assim, o hidróxido de sódio, – uma lixívia, o que tem sido amplamente usado em diversos campos de actividade humana, devido à sua natureza quimicamente reactivo.