Nomenclatura Internacional de alcanos. Alcanos: estrutura, das propriedades
É útil começar com uma definição de alcanos. Este saturado ou saturado hidrocarbonetos, parafinas. Também pode dizer que carbonos em que átomos de composto C é realizada por meio de relações simples. A fórmula geral é da forma: CnH₂n + 2.
Sabe-se que a proporção de átomos de H e C nas suas moléculas quanto possível quando comparado com outras classes. Dado que todas as valências estão ocupadas ou C, ou H, e as propriedades químicas dos alcanos expressa brilhantemente suficiente, de modo que o seu segundo nome sobressai frase limite ou hidrocarbonetos saturados.
há também um nome mais antigo que melhor reflecte a sua himinertnost relativa – parafinas, que traduzido significa "falta de afinidade".
Assim, o tema da conversa do nosso hoje: "Alka: homólogo série, nomenclatura, estrutura, isomeria". Também irá apresentar dados sobre as suas propriedades físicas.
Alcanos: estrutura, nomenclatura
Nestes átomos de C estão em tal estado como sp3-hibridação. Portanto molécula alcano pode ser demonstrada como um conjunto de estruturas de átomos C, o qual está ligado não só entre si, mas também com H. 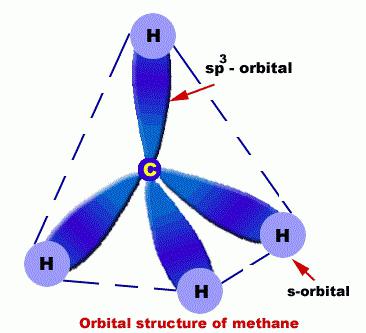
Entre átomos de C e H estão presentes muito baixa s-ligação durável, polar. Os átomos em torno de ligações simples sempre rodar como uma consequência de alcanos moléculas assumir diferentes formas, em que o comprimento da ligação, o ângulo entre eles – são constantes. Formas, que são transformados em si, devido à rotação da molécula, o que ocorre em torno das s-laços, referida como a sua conformação. 
No processo de desprendimento dos átomos de H da molécula forma um partículas 1-valentes chamados radicais de hidrocarbonetos. Estes compostos são o resultado não apenas compostos orgânicos , mas também inorgânicos. Se dois átomo de hidrogénio a partir de um limite de subtração molécula de hidrocarboneto, obtém-se os radicais 2-valência.
Assim alcanos podem ser nomenclatura:
- radial (versão antiga);
- Substituição (internacional, sistemática). Ela proposta pela IUPAC.
Especialmente nomenclatura radial
No primeiro caso, alcanos nomenclatura são caracterizadas como se segue:
- hidrocarbonetos consideração como derivados de metano, o qual é substituído por 1 ou mais átomos de H radicais.
- O elevado grau de conveniência, no caso de compostos não muito complexas.
Características da nomenclatura de substituição
Substituição nomenclatura alcano tem as seguintes características:
- A base para o nome – uma cadeia de carbono, e os restantes fragmentos moleculares são considerados como substituintes.
- Se houver vários radicais idênticos antes de o seu nome indica o número (estritamente em palavras), e os números de radicais separados por vírgulas.
Química: nomenclatura de alcanos
Por conveniência, a informação é apresentada em forma de tabela.
|
Nome da substância |
A base do nome (raiz) |
fórmula molecular |
Vice Nome de carbono |
substituinte carbono Fórmula |
|
metano |
met |
CH₄ |
metilo |
CH₃ |
|
etano |
etno |
C₂H₆ |
etilo |
C₂H₅ |
|
propano |
escorar |
C₃H₈ |
propilo |
C₃H₇ |
|
gás butano |
mas- |
C₄H₁₀ |
butilo |
C₄H₉ |
|
pentano |
encerrado |
C₅H₁₂ |
pentil |
C₅H₁₁ |
|
hexano |
feitiço |
C₆H₁₄ |
hexilo |
C₆H₁₃ |
|
heptano |
hept |
C₇H₁₆ |
heptil |
C₇H₁₅ |
|
octano |
outubro |
C₈H₁₈ |
octil |
C₈H₁₇ |
|
nonano |
n em |
C₉H₂₀ |
nonil |
C₉H₁₉ |
|
decano |
dextrano |
C₁₀H₂₂ |
decil |
C₁₀H₂₁ |
Os alcanos de nomenclatura acima incluem nomes historicamente são formados (os primeiros 4 períodos de hidrocarbonetos saturados da série).
alcanos aqui nondeployed com 5 ou mais C formados a partir dos átomos de numerais gregas que reflectem um dado número de átomos de C. Assim sufixo -en indica que a substância de um número de compostos saturados. 
No desenho títulos implantado alcanos como a cadeia principal é seleccionada a uma que contém o número máximo de átomos de C. É numeradas de modo a que os substituintes têm o menor número. No caso de duas ou mais cadeias de comprimento igual torna-se a principal que contém o maior número de substituintes.
isomeria de alcanos
Como hidrocarboneto-fundador de um certo número de actos de metano CH₄. Com cada representante da série metano observado em contraste com o grupo de metileno anterior – CHO. Este padrão pode ser rastreada ao longo da série de alcanos.
cientista alemão Schill apresentar uma proposta para nomear o número de homólogos. Traduzido do grego que significa "semelhante, como."
Assim, a série homóloga – um conjunto de compostos orgânicos relacionados que têm o mesmo tipo de estrutura com perto himsvoystvami. Homólogos – os membros da série. diferença homóloga – grupo metileno, através da qual os dois homólogo adjacente diferente.
Como mencionado anteriormente, qualquer composição do hidrocarboneto saturado pode ser expresso pela fórmula geral CnH₂n + 2. Assim, após o metano é um membro da série homóloga de etano – C₂H₆. Para deduzir a estrutura de metano, é necessária a substituição do átomo de H na posição 1 CH (figura abaixo). 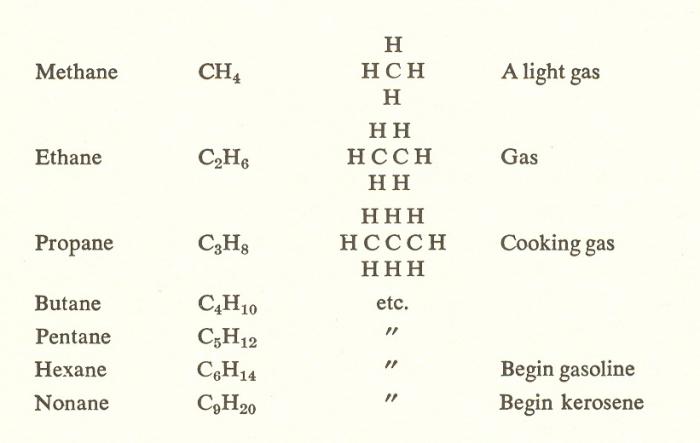
A estrutura de cada homólogo subsequente pode ser derivada a partir do de cima, do mesmo modo. Como um resultado de etano formado propano – C₃H₈.
Quais são isômeros?
São substâncias que têm uma composição idêntica qualitativa e quantitativa molecular (fórmula molecular idêntica) mas estruturas químicas diferentes e tendo himsvoystvami diferente.
Caracterizado por os hidrocarbonetos mencionados acima sobre os tais parâmetros como a temperatura de ebulição: -0,5 ° – butano, -10 ° – isobutano. Este tipo de isomerismo referidas isomerismo esqueleto carbonado como, relaciona-se com o tipo estrutural.
O número de isómeros estruturais aumenta rapidamente com o número de átomos de carbono. Assim, C₁₀H₂₂ corresponderá isómeros 75 (não incluindo o espaço), e para 4347 C₁₅H₃₂ isómeros já conhecidos, por C₂₀H₄₂ – 366.319.
Então, já estava claro que um tal alcanos, série homóloga, isomeria, nomenclatura. Agora é necessário ir com as regras para nomes IUPAC. 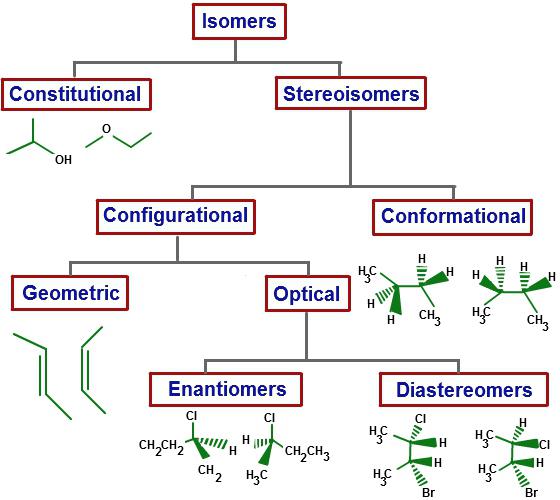
IUPAC nomenclatura: O nome da educação
Em primeiro lugar, é necessário encontrar uma estrutura de uma cadeia de carbono de hidrocarbonetos, que contém a maior comprimento e o número máximo de substituintes. Em seguida, o número necessário na cadeia átomos de C, começando a partir da extremidade, que é mais próximo substituinte.
Em segundo lugar, a base – o nome do hidrocarboneto saturado não ramificado, o qual corresponde ao número de átomos de C representa a cadeia principal.
Em terceiro lugar, antes da fundação deve especificar quartos lokantov, que estão localizados perto dos Deputados. Eles foram escritos suplentes nome com hífen.
Em quarto lugar, em caso de substituintes idênticos em diferentes átomos de C lokanty juntos, em que antes do nome aparece multiplica prefixo: di – dois substituintes idênticos três – a três, tetra – quatro, penta – a cinco, etc .. As Figuras eles devem ser separados por uma vírgula, e das palavras – hífen.
Se um e o mesmo omo de C continha apenas dois substituintes lokant também registados duas vezes.
De acordo com essas regras, e formou uma nomenclatura internacional de alcanos. 
projecção de Newman
Este cientista americano sugeriu para conformações demonstração gráfica fórmula projeção especial – projeção Newman. Eles correspondem às formas A e B e C são mostrados na figura abaixo. 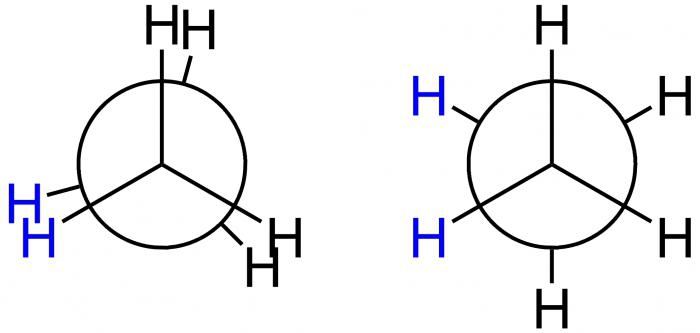
No primeiro caso de conformação A-eclipsada, enquanto o segundo – B-inibida. Na posição átomos Uma H estão localizados a uma distância mínima entre si. Esta forma corresponde ao maior valor da energia devido ao fato de que a maior repulsão entre as mesmas. Este estado energeticamente desfavorável, pelo que a molécula tende a deixá-lo, e mover-se para uma posição mais estável B. Aqui os átomos de H da máxima distância um do outro. Assim, a diferença de energia destas disposições – 12 kJ / mol, de modo que a rotação livre em torno do eixo do etano molécula, que liga os grupos metilo obtido desigual. Uma vez na posição energeticamente favorável da molécula não está atrasado, em outras palavras, o "freio". É por isso que é chamado de retardado. Resultado -. 10 mil moléculas são etano sob a forma de conformação fornecida temperatura ambiente inibida. Apenas um tem uma forma diferente – eclipsado.
Preparação de hidrocarbonetos saturados
A partir do artigo, soube-se que esta alcanos (estrutura, nomenclatura deles descrito em pormenor anteriormente). Seria supérfluo examinar os seus métodos de preparação. Eles são extraídas a partir de fontes naturais tais como o óleo, gás natural, gás associada, carvão. aplicam-se também métodos sintéticos. Por exemplo, H ^ 2H₂:
- O processo de hidrogenação de hidrocarbonetos insaturados: CnH₂n (alcenos) → CnH₂n + 2 (alcanos) ← CnH₂n-2 (alcinos).
- Monóxido de uma mistura de C e H – g de stese: nCO + (2n + 1) H ^ → CnH₂n + 2 + nH₂O.
- A partir de ácidos carboxílicos (sais dos mesmos): a electrólise no ânodo para o cátodo:
- Kolbe electrólise: 2RCOONa + 2H₂O → R-R + 2CO₂ + H ^ + 2 NaOH;
- reacção Dumas (liga com álcali): CH₃COONa + NaOH (t) → CH₄ + Na₂CO₃.
- Craqueamento de petróleo: CnH₂n + 2 (450-700 °) → CmH₂m + 2 + Cn-mH₂ (nm).
- A gaseificação de combustível (sólido): C + 2H₂ → CH₄.
- Síntese de complexos (alcanos halogenados) que têm um número mínimo de átomos de C: 2CH₃Cl (clorometano) + 2Na → CH₃- CH (etano) + 2NaCl.
- methanide expansão água (carbonetos metálicos): Al₄C₃ + 12H₂O → 4Al (OH₃) ↓ + 3CH₄ ↑.
As propriedades físicas dos hidrocarbonetos saturados
Para maior comodidade, os dados são agrupados na tabela.
|
fórmula |
alcano |
O ponto de fusão em ° C |
O ponto de ebulição em ° C |
Densidade, g / ml |
|
CH₄ |
metano |
-183 |
-162 |
0,415 em t = -165 ° C |
|
C₂H₆ |
etano |
-183 |
-88 |
0,561 em t = -100 ° C |
|
C₃H₈ |
propano |
-188 |
-42 |
0,583 a t = -45 ° C |
|
n-C₄H₁₀ |
n-Butano |
-139 |
-0.5 |
0,579 em t = 0 ° C |
|
2-metilpropano |
– 160 |
– 12 |
0,557 a t = -25 ° C |
|
|
2,2-Dimetil-propano |
– 16 |
9,5 |
0613 |
|
|
n-C₅H₁₂ |
de n-Pentano |
-130 |
36 |
0,626 |
|
2-metilbutano |
– 160 |
28 |
0620 |
|
|
n-C₆H₁₄ |
n-Hexano |
– 95 |
69 |
0,660 |
|
2-metilpentano |
– 153 |
62 |
0,683 |
|
|
n-C₇H₁₆ |
n-Heptano |
– 91 |
98 |
0.683 |
|
N-C₈H₁₈ |
N-Octano |
– 57 |
126 |
0,702 |
|
2,2,3,3-tetra-metilbutano |
– 100 |
106 |
0.665 |
|
|
2,2,4-Trimetilpentano |
– 107 |
99 |
0.692 |
|
|
N-C₉H2₀ |
N-Nonan |
– 53 |
151 |
0,718 |
|
N-C₁₀H₂₂ |
N-Decan |
– 30 |
174 |
0,730 |
|
N-C18H24 |
N-Undekan |
– 26 |
196 |
0,740 |
|
N-C12H20 |
N-Dodecane |
– 10 |
216 |
0.748 |
|
N-C18H2 |
N-Tridecan |
– 5 |
235 |
0.756 |
|
N-C14H3O |
N-tetradecano |
6º |
254 |
0.762 |
|
N-C15H3-2 |
N-Pentadecane |
10 |
271 |
0,768 |
|
N-C16H3₄ |
N-Hexadecano |
18 |
287 |
0.776 |
|
N-C2₀H₄₂ |
N-Eicosane |
37 |
343 |
0.788 |
|
N-C₃₀H₆₂ |
N-Triacultan |
66 |
235 com 1 mm Hg. Art. |
0.779 |
|
N-C₄₀H₈₂ |
N-Tetracontan |
81 |
260 em 3 mm de mercúrio. Art. |
|
|
N-C₅₀H₁₀₂ |
N-Pentacontan |
92 |
420 em 15 mm de mercúrio. Art. |
|
|
N-C₆₀H₁₂₂ |
N-Hexacontane |
99 |
||
|
N-C02H14 |
N-HeptaContan |
105 |
||
|
N-C₁₀H2₀₂ |
N-Heptano |
115 |
Conclusão
O artigo considerou tal conceito como alcanos (estrutura, nomenclatura, isomerismo, série de homologia, etc.). Diz-se um pouco sobre as características das nomenclaturas radiais e de substituição. São descritos métodos para a preparação de alcanos.
Além disso, o artigo enumera em detalhes toda a nomenclatura de alcanos (o teste pode ajudar a assimilar a informação obtida).