fórmula molecular metano e estrutural
fórmula molecular, estrutural e electrónicos de metano são baseados na teoria da estrutura de compostos orgânicos Butlerov. Antes de escrever estas fórmulas, começamos com uma breve caracterização do hidrocarboneto.

Características de metano
Esta substância é um explosivo, também é chamado de gás "pântano". O cheiro específico dos hidrocarbonetos limitantes conhecidos de todos. O processo de combustão do mesmo é deixado componentes químicos prejudiciais para o corpo humano. Que o metano é um participante ativo na formação do efeito estufa.
Propriedades físicas
O primeiro representante da série homóloga de alcanos foi descoberto por cientistas na atmosfera de Titã e Marte. Dado o fato de que o metano está relacionada com a existência de organismos vivos apareceu hipótese da existência de vida nesses planetas. Em Saturn, Júpiter, Neptune, Urano, produto de metano apareceu processamento como química de substâncias de origem inorgânica. Na superfície do nosso planeta ao seu baixo teor.
características gerais
O metano não tem cor, que é mais leve do que o ar quase duas vezes, é pouco solúvel em água. A composição do gás natural a montante atinge 98 por cento. O gás de petróleo passando contém de 30 a 90 por cento de metano. Em mais metano é de origem biológica.
Ungulates herbívoros cabras e vacas emitem o processamento nos estômagos de bactérias quantidade bastante significativa de metano. Entre as fontes importantes da série homóloga de alcanos selecione pântanos, térmitas, filtragem de gás natural da planta da fotossíntese. Na detecção de traços de metano no planeta, nós podemos falar sobre a existência de vida biológica.

Os métodos para a preparação
A fórmula estrutural detalhada de metano é evidência de que na sua molécula única saturada ligações simples formados nuvens híbridas. preparação laboratorial formas de realização adicionais da nota de hidrocarboneto de liga com acetato de sódio sólido com alcali, e a interacção de carbureto de alumínio com água.
Sólido metano chama azulada, salientando ao mesmo tempo da ordem de 39 MJ por metro cúbico. mistura explosiva forma a substância ao ar. O metano mais perigoso, que é liberado durante a mineração subterrânea de depósitos minerais nas minas de montanha. Alto risco de explosão de plantas de metano e de beneficiamento de carvão e briquetes, bem como indústrias de classificação.
efeito fisiológico
Se a percentagem de metano no ar é de 5 a 16 por cento, em contacto com o oxigénio pode ser inflamado metano. No caso de um aumento significativo na mistura do produto químico aumenta a probabilidade de explosão.
Se a concentração de ar do alcano é de 43 por cento, é a causa asfixia.
Com a velocidade de propagação da explosão de 500 a 700 metros por segundo. Uma vez que o metano é posto em contacto com uma fonte de calor, o processo de ignição alcano ocorre com um certo atraso.
Foi nesta produção baseada propriedade de equipamentos eléctricos à prova de explosão e segurança de componentes explosivos.
Uma vez que o metano é o hidrocarboneto saturado mais termicamente estável, ele é amplamente utilizado como combustível doméstico e industrial e também é utilizada como uma matéria-prima valiosa para a síntese química. A fórmula estrutural de etil-tri-metano caracteriza as características estruturais dos membros desta classe de hidrocarbonetos.
No processo de reacção química com cloro por exposição à radiação ultravioleta pode ser formado de vários produtos da reacção. Dependendo da quantidade de material inicial pode estar na substituição receber clorometano, clorofórmio, tetracloreto de carbono.
Em caso de queima incompleta do metano formado fuligem. O formaldeído é formado, no caso de oxidação catalítica. O produto de reacção final é dissulfeto de carbono com enxofre.

estrutura metano propriedades
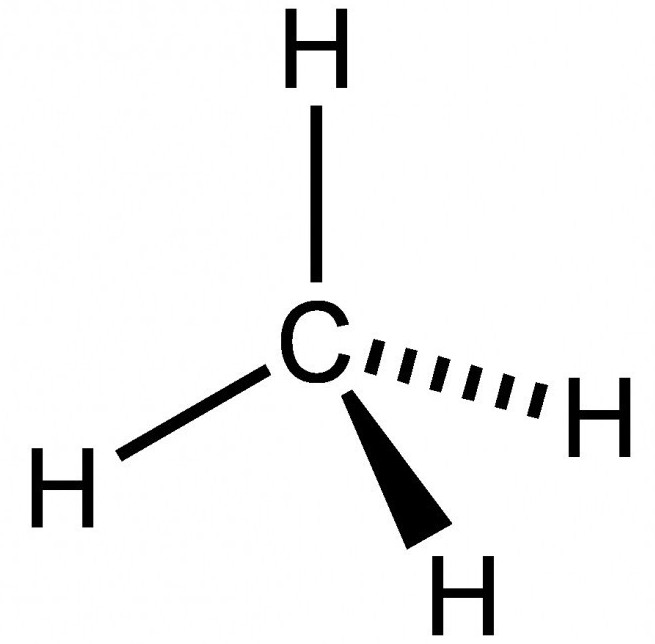
Qual é sua fórmula estrutural? Metano refere-se a hidrocarbonetos saturados que têm a fórmula geral C n H 2n + 2. Considere-se uma formação molécula particular para explicar como a fórmula estrutural é formado.
O metano é composto por um átomo de carbono e quatro átomos de hidrogénio ligados entre si por momento de dipolo ligação covalente. Nós explicar a estrutura com base nos átomos de carbono fórmulas estruturais.
Ver hibridização
A estrutura espacial de metano caracterizado por estrutura tetraédrica. Desde externamente no carbono quatro electrões de valência, transição de electrões ocorre no átomo de aquecimento com um segundo s-orbitais em p. Como resultado, o último nível de potência no carbono localizado quatro não emparelhado ( "livre") do elétron. fórmula estrutural total de metano está baseada no facto de que a formação das quatro nuvens híbridas que estão orientados no espaço, num ângulo de 109 graus e 28 minutos, formando uma estrutura de tetraedro. Além disso, há sobreposição vértices nuvens híbridas com átomos de nuvens de hidrogénio não híbridas.
fórmula estrutural completa e metano condensado satisfaz plenamente teoria Butlerova. Entre ligação formas de carbono e de hidrogénio simples (única), de modo que as reacções químicas não são de ligação normal.
Abaixo encontra-se a fórmula estrutural final. Metano – é o primeiro representante da classe de hidrocarbonetos saturados, que tem propriedades típicas limitar alcano. fórmula estrutural E e metano confirmar o tipo de hibridação de átomo de carbono na matéria orgânica.

Do curso de química da escola
Esta classe de hidrocarbonetos, representante do que é um "gás de pântano", estudou no curso de 10 classe do ensino médio. Por exemplo, crianças proposto tarefa seguinte caráter: "Escrever fórmulas estruturais de metano". Deve ser entendido que apenas uma configuração estrutural detalhada para esta substância pode ser pintado na teoria Butlerova.
A sua fórmula encurtado vai ser o mesmo que o molecular, escrito sob a forma de CH4. Sob as novas normas federais de educação que são impostas em conexão com a reorganização da educação russa no curso básico de química todos os assuntos relacionados com as características das classes de substâncias orgânicas, entender vigilância.
síntese industrial
processos industriais baseados em metano como um componente químico importante têm sido desenvolvidos como o acetileno. A base de craqueamento térmico ou eléctrico era precisamente a sua fórmula estrutural. Metano na oxidação catalítica de amoníaco para formar o ácido cianídrico.
Aplicar este material orgânico para a produção de gás de síntese. Por reacção com vapor de água, uma mistura de monóxido de carbono e hidrogénio, que são matérias-primas para o limite de produção de álcoois mono-hídricos, compostos de carbonilo.
De particular importância é a reacção com ácido nítrico, resultando em nitrometano.

O uso como combustível
Devido à falta de fontes naturais de hidrocarbonetos, bem como o empobrecimento da base de recursos, especialmente questão relevante relacionada com a busca de novas fontes (alternativas) para o combustível. Uma tal opção é o biodiesel, que incluiu lá e metano.
Dada a diferença de densidade entre a gasolina e o primeiro membro da classe de alcanos, há certas características em sua aplicação como uma fonte de energia para os motores de automóveis. A fim de evitar a necessidade de transportar uma grande quantidade de metano, por compressão, para aumentar a sua densidade (sob uma pressão de cerca de 250 atmosferas). O metano armazenado no estado liquefeito em cilindros instalados no veículo.
A exposição à atmosfera
Nós já discutimos o fato de que o metano tem um impacto sobre o efeito estufa. Se o grau de acção de monóxido de carbono (4) sobre o clima convencionalmente tomado como unidade, então isso fracção 'pântano gás' é de 23 unidades. Ao longo dos últimos dois séculos, os cientistas observaram um aumento no conteúdo quantitativo de metano na atmosfera da Terra.
Atualmente, a quantidade aproximada de CH4 é estimado em 1,8 partes por milhão. Apesar do facto de que este valor é de 200 vezes menos do que a presença de dióxido de carbono, há uma conversa entre os cientistas sobre o possível risco de aprisionamento de calor emitida pelo planeta.
Devido à excelente calorífico 'pântano gás' é usado não só como matéria-prima para a realização da síntese química, mas também como fonte de energia.
Por exemplo, o metano operar uma variedade de caldeiras a gás, colunas, projetadas para sistemas de aquecimento individuais em casas particulares e casas de campo.
Tal opção de auto-aquecimento é muito benéfico para os proprietários, não relacionadas com o acidente, tendo sistematicamente lugar em sistemas de aquecimento centralizado. caldeira a gás devido operar num determinado tipo de combustível, é o suficiente para 15-20 minutos para aquecer totalmente a casa de dois andares.

conclusão
Metano, estrutural e fórmulas moleculares dos quais foram dados acima, uma fonte natural de energia. Devido ao facto de que ele inclui apenas átomos de carbono e hidrogénio, ambientalistas reconhecer a segurança ambiental do hidrocarboneto saturado.
Sob condições padrão (temperatura do ar de 20 graus Celsius e uma pressão de 101.325 Pa) a substância é gasoso, não tóxico, insolúvel em água.
No caso da temperatura do ar é reduzida a -161 graus, que é o metano comprimido que é amplamente utilizado na indústria.
O metano tem um impacto sobre a saúde humana. Não é uma substância tóxica, mas é um gás sufocante. Há ainda limites (MAC) sobre o teor de substâncias químicas na atmosfera.
Por exemplo, a trabalhar nas minas são permitidos somente nos casos em que o montante não exceda o por metro cúbico a 300 miligramas. Analisando as características de uma estrutura da matéria orgânica possível concluir que as similaridades nas propriedades químicas e físicas com todos os outros membros da classe de (limite) hidrocarbonetos saturados.
Analisamos a fórmula estrutural, a estrutura espacial de metano. série homóloga que começa "gás pântano" tem a fórmula molecular C n H 2n + 2 geral.