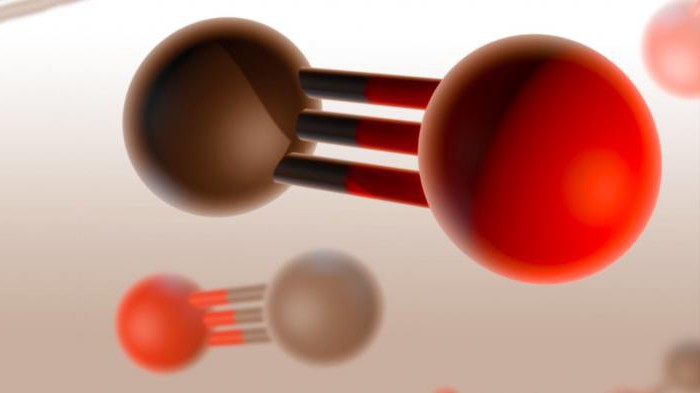
monóxido de carbono, também conhecido como o monóxido de carbono, tem uma estrutura molecular muito forte, é inerte para as propriedades químicas e é pouco solúvel em água. Este composto também é extremamente tóxica quando libertado para o sistema respiratório é ligado à hemoglobina no sangue, e que deixa de oxigénio de transferência para os tecidos e órgãos.
Nome químico e fórmula
O monóxido de carbono é também conhecida por outros nomes, incluindo o monóxido de carbono II. Na vida cotidiana, é geralmente chamado de monóxido de carbono. Este monóxido de carbono é um gás venenoso, incolor e sem gosto, sem odor. A sua fórmula química – CO, e a massa de uma única molécula é 28,01 g / mol.

Efeitos sobre o corpo
O monóxido de carbono se liga à hemoglobina para formar a carboxihemoglobina que não é transportar oxigénio, capacidade. A inalação do vapor faz com que lesões do SNC (sistema nervoso central), e asfixia. A consequente falta de oxigénio faz com que a dor de cabeça, tonturas, diminuição do ritmo cardíaco e frequência respiratória, levando à morte inconsciência e subsequente do organismo.

gás tóxico
O monóxido de carbono é produzido por combustão parcial de substâncias contendo carbono, tais como em motores de combustão interna. O composto 1 inclui um átomo de carbono ligado covalentemente a um átomo de oxigénio. O monóxido de carbono é altamente tóxico, e isto é uma das causas mais comuns de envenenamento fatal em todo o mundo. A exposição pode levar a danos ao coração e outros órgãos.
Qual é o uso de monóxido de carbono?
Apesar da sua toxicidade grave, o monóxido de carbono é extremamente útil – graças à tecnologia moderna dela para criar toda uma gama de produtos vitais. O monóxido de carbono, embora hoje é considerada um contaminante sempre presente na natureza, mas não numa quantidade tal como, por exemplo, dióxido de carbono.
Enganados estão aqueles que acreditam que não há nenhuma conexão de monóxido de carbono na natureza. CO dissolvido na rocha vulcânica fundido a pressões elevadas no manto da Terra. O teor de óxidos de carbono nos gases vulcânicos varia de menos do que 0,01% a 2%, dependendo do vulcão. Desde natural, este composto não é um valor constante, para medir com precisão as emissões de gás natural não é possível.

Propriedades químicas
O monóxido de carbono (fórmula CO) refere-se a óxidos de nesoleobrazuyuschim ou indiferentes. No entanto, a uma temperatura de 200 ° C que reage com hidróxido de sódio. Durante este processo químico é a formação de formato de sódio:
NaOH + CO = HCOONa (sal de ácido fórmico).
Propriedades de monóxido de carbono com base na sua capacidade de resistência. Monóxido de Carbono:
- pode ser feito reagir com oxigénio: 2CO + O2 = 2CO 2;
- capaz de reagir com átomos de halogénio: CO + Cl 2 = COCl 2 (fosgénio);
- Ele tem a propriedade única de recuperação de metais puros dos seus óxidos: Fe 2 O 3 + 3CO = 2Fe + 3CO 2;
- formar carbonilos metálicos: Fe + 5CO = Fe (CO ) 5;
- perfeitamente solúvel em clorofórmio, ácido acético, etanol, benzeno e hidróxido de amónio.
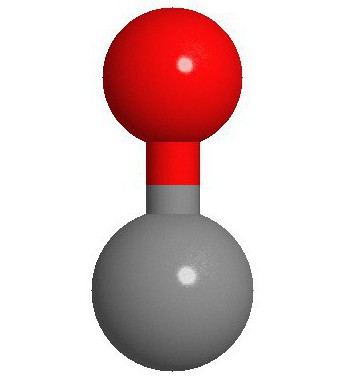
A estrutura da molécula
Dois átomos dos quais, na verdade, é uma molécula de monóxido de carbono (CO), ligação tripla ligada. Dois deles são formados pela fusão de p-electrões dos átomos de carbono com o oxigénio, e o terceiro – graças ao mecanismo especial devido à livre 2p carbono pares orbitais e o electrões 2p de oxigénio. Esta estrutura proporciona uma molécula de alta resistência.
Um pouco de história
Aristóteles da Grécia antiga descreveu os gases tóxicos produzidos pela queima de carvão. O próprio mecanismo de morte era desconhecida. No entanto, um dos métodos antigos de punição foi bloqueio conflito com a lei na sala de vapor, onde as brasas eram. O médico grego Galeno sugeriu que no ar há certas mudanças que causam danos se inalado.
Durante a Segunda Guerra Mundial, a mistura de gases com impurezas de monóxido de carbono, foi usado como um combustível para veículos nessas partes do mundo, onde houve uma quantidade limitada de gasolina e diesel. externo (com algumas excepções) geradores de carvão ou gás de madeira ter sido estabelecida, mas uma mistura de azoto atmosférico, o monóxido de carbono, e pequenas quantidades de outros gases fornecidos ao misturador de gás. Este foi o chamado gás de madeira.

A oxidação do monóxido de carbono
O monóxido de carbono produzido na oxidação parcial de compostos carbonados. CO é formado quando o oxigénio insuficiente para produzir dióxido de carbono (CO 2), por exemplo, durante a operação da fornalha ou motor de combustão interna num espaço fechado. Se o oxigénio está presente, bem como alguns outros concentração atmosférica de queima de monóxido de carbono, que irradia luz azul, formando dióxido de carbono, conhecida como o dióxido de carbono.
O dióxido de carbono é amplamente utilizado até os anos 1960 do século passado para instalações de iluminação de interiores, cozinhar e para aquecimento, ele teve com uma parte do combustível como um componente prioridade. Alguns processos em tecnologias modernas, tais como ferro fundição ainda produzem monóxido de carbono como subproduto. A própria ligação de CO é oxidado a CO2 à temperatura ambiente.
Existe uma CO na natureza?
Se há monóxido de carbono na natureza? Uma de suas fontes de origem natural são reações fotoquímicas na troposfera. Estes processos são assumidos como sendo capaz de produzir cerca de 5 × 10 kg de Dezembro de agentes E; oje. Entre outras fontes, como mencionado acima, são vulcões, fogos florestais e outros tipos de combustão.
propriedades moleculares
O monóxido de carbono tem uma massa molar de 28,0, o que faz com que seja ligeiramente menos denso do que o ar. comprimento de ligação entre dois átomos de – 112,8 micrómetros. É perto o suficiente para fornecer uma das ligações químicas mais fortes. Ambos os elementos em conjunto com CO tem cerca de 10 electrões na camada de valência de um.
Como regra, o carbonilo orgânico compostos existe uma ligação dupla. Uma característica da molécula de CO é o que ocorre entre os átomos de fortes compartilhou electrões com ligação tripla 6 3 orbitais moleculares associados. Uma vez que quatro dos electrões partilhados são originários a partir de um átomo de oxigénio e dois apenas a partir de carbono, um ocupado por dois electrões orbitais associados de O 2, que formam um dipolo ou ligação dativa. Isto faz com que C ← O polarização de moléculas com uma carga pequena "-" em carbono e uma pequena taxa de "+" no oxigénio.
Os restantes dois orbitais associados é ocupada por uma partícula carregada de carbono e um átomo de oxigénio. A molécula é assimétrica: oxigénio tem uma densidade de electrões superior de carbono e é também ligeiramente carregado positivamente, em comparação com um carbono negativo.
recepção
Na indústria, a obtenção de monóxido de carbono CO que é levada a cabo por aquecimento do dióxido de carbono, sem acesso de ar ou de vapor de água com carvão:
CO2 + C = 2CO;
H 2 O + C = CO + H 2.
O último também é chamado a mistura resultante foi vapor ou gás de síntese. Sob condições laboratoriais, o monóxido de carbono II sujeitando o ácido orgânico, ácido sulfúrico concentrado, o qual actua como um agente de desidratação:
HCOOH = CO + H2O;
H 2 C 2 O 4 = CO 2 + H 2 O.
Os principais sintomas e ajudar com envenenamento por CO
Será que o envenenamento por monóxido de carbono? Sim, e muito forte. envenenamento por monóxido de carbono é o fenômeno mais comum em todo o mundo. Os sintomas mais comuns são:
- uma sensação de fraqueza;
- náuseas;
- tonturas;
- fadiga;
- irritabilidade;
- perda de apetite;
- dor de cabeça;
- desorientação;
- visão turva;
- vômitos;
- desmaio;
- convulsões.
A exposição a este gás tóxico pode causar danos significativos, o que frequentemente pode conduzir a estados patológicos crónicos a longo prazo. O monóxido de carbono é susceptível de provocar danos graves para o feto de uma mulher grávida. As vítimas, por exemplo, depois de um incêndio, deve fornecer ajuda imediata. uma necessidade urgente de chamar uma ambulância, dar acesso para o ar fresco, roupas limpas que dificultam a respiração, acalmar, quente. envenenamento grave é geralmente tratada apenas sob a supervisão de médicos no hospital.
aplicação
O monóxido de carbono é, como já mencionado, é tóxico e perigoso, mas é um dos compostos básicos os quais são utilizados na indústria moderna para a síntese orgânica. CO é utilizado para a produção de metais puros, carbonilos, fosgénio, sulfureto de carbono, álcool metílico, formamida, aromáticos aldeídos, fórmico ácido. Esta substância também é usada como combustível. Apesar da sua toxicidade e a toxicidade, que é frequentemente utilizado como uma matéria-prima para a produção de várias substâncias na indústria química.
Monóxido de carbono e dióxido de carbono: qual é a diferença?
Monóxido de carbono e dióxido de carbono (CO e de CO 2) são muitas vezes confundido com o outro. Ambos os gases são inodoro, incolor, e ambos têm um impacto negativo sobre o sistema cardiovascular. Ambos os gases podem entrar no corpo através de inalação, pele e olho. Estes compostos, quando expostos a organismos vivos compartilham uma série de sintomas – dores de cabeça, tonturas, convulsões e alucinações. A maioria das pessoas dificilmente fazem a diferença e não percebem que os gases de escape do carro emitidos como CO e CO2. Dentro do aumento da concentração desses gases pode ser perigosa para a saúde humana e segurança, sujeito à sua influência. Qual é a diferença?
A altas concentrações de ambos pode ser fatal. A diferença reside em que o CO 2 é um gás natural comum, necessária para toda a vida vegetal e animal. CO não é comum. Esta combustão sem oxigénio subproduto. A diferença química crítico sendo que o CO 2 tem um átomo de carbono e dois átomos de oxigénio, enquanto que apenas CO-os um por um. O dióxido de carbono é não-inflamáveis, enquanto que o monóxido é mais provável para pegar fogo.
O dióxido de carbono é naturalmente encontrada na atmosfera, pessoas e animais respiram oxigénio e dióxido de carbono exalado, i.e. seres ele pode resistir a uma pequena quantidade. Este gás também é necessário para a fotossíntese pelas plantas. No entanto, o monóxido de carbono não ocorre naturalmente na atmosfera, e pode causar problemas de saúde, mesmo em baixas concentrações. Ambos densidade de gás também é diferente. O dióxido de carbono é mais pesado e mais denso do que o ar, enquanto que o monóxido de carbono é um pouco mais fácil. Esta peculiaridade é levado em conta no estabelecimento dos sensores apropriados nas casas.