A concentração e a densidade do ácido sulfúrico. A dependência da densidade da concentração de ácido sulfúrico na bateria do carro
Dilui-se e concentrou-se ácido sulfúrico – produtos químicos é tão importante que eles produzem mais no mundo do que qualquer outra substância. riqueza económica do país pode ser avaliada em termos de ácido sulfúrico nele produzido.
processo de dissociação
O ácido sulfúrico é utilizado sob a forma de soluções aquosas de várias concentrações. Ela sofre dissociação da reacção em duas etapas, a produção de iões de H + são em solução.
H 2 SO 4 = H + + HSO 4 -;
HSO 4 -, = H + + SO 4 -2.
O ácido sulfúrico é um forte, e a primeira fase de dissociação ocorre tão rapidamente que praticamente toda a molécula original decompõem-se em H + -ions e HSO 4 -1 -ions (sulfato de hidrogénio), em solução. Recentes parcialmente desintegrar-se ainda mais, libertando iões H + e outro deixando um ião sulfato (SO4 -2) em solução. No entanto, hidrogenossulfato, ser um ácido fraco, ainda prevalece em uma solução de H + e SO4 -2. dissociação completa que só ocorre quando a densidade da solução de ácido sulfúrico está perto da densidade da água, r. F sob alta diluição. 
Propriedades de ácido sulfúrico
É especial no sentido de que ele pode actuar como um ácido convencional ou um oxidante forte – dependendo da temperatura e da concentração. Uma solução diluída fria de ácido sulfúrico reage com o metal activo, para dar o sal de (sulfato) e a evolução de gás de hidrogénio. Por exemplo, a reacção entre diluído frio de H 2 SO 4 (assumindo a sua dissociação-passo completo) e zinco metálico como se segue:
Zn + H 2 SO 4 = ZnSO 4 + H 2.
O ácido sulfúrico concentrado a quente, cuja densidade é de cerca de 1,8 g / cm 3, podem actuar como um oxidante, fazendo reagir com os materiais que são geralmente inerte aos ácidos, tais como, por exemplo cobre metálico. Durante a reacção, o cobre é oxidado, e a massa de ácido é reduzida, uma solução é formado de sulfato de cobre (II) em água e dióxido gasoso de enxofre (SO2) em vez de hidrogénio, o que seria de esperar por reacção do ácido com um metal.
Cu + 2H 2 SO 4 = CuSO4 + SO 2 + 2H 2 O. 
Como geralmente expressa pela concentração de soluções
Na verdade, a concentração de qualquer solução pode ser expresso de maneiras diferentes, mas a concentração mais amplamente usados em peso. Ela mostra o número de gramas de soluto num determinado peso ou o volume da solução ou solvente (tipicamente 1,000 g, 1,000 cm3, com 100 cm3 e 1 dm 3). Em vez da massa em gramas de uma substância pode tomar a quantidade, expressa em moles, – em seguida, a obtida a uma concentração molar de 1000 g ou 1 dm3 solução.
Se a concentração molar determinada no que diz respeito não à quantidade da solução, mas apenas ao solvente, é chamado de molalidade o da solução. Caracteriza-se pela independência da temperatura.
Muitas vezes, a concentração de peso indicado em gramas por 100 gramas de solvente. Multiplicando este número por 100%, é preparado em um por cento em peso (por concentração). Ou seja, este método é mais frequentemente utilizado como aplicado a uma solução de ácido sulfúrico.
Cada valor da concentração da solução, determinada a uma dada temperatura, que corresponde a uma densidade muito específico (por exemplo, a densidade da solução de ácido sulfúrico). Portanto, às vezes é caracterizada solução. Por exemplo, H 2 SO 4, caracterizado concentração percentual de 95,72%, uma densidade de 1,835 g / cm 3, em t = 20 ° C. Como para determinar a concentração de uma solução tal, se for dada apenas a densidade sulfúrico ácido? Tabela dando tal correspondência é um dispositivo elétrico de qualquer livro sobre química geral ou analítica.
recalculo concentração EXEMPLO
Vamos passar de um modo de expressão para outra concentração da solução. Suponhamos que temos H 2 SO 4 soluo em água com a concentração de 60% de interesse. Em primeiro lugar, definir a densidade do ácido sulfúrico correspondente. Tabela contendo percentagens (primeira coluna) e a densidade correspondente da solução aquosa de H 2 SO 4 (quarta coluna), é mostrado abaixo. 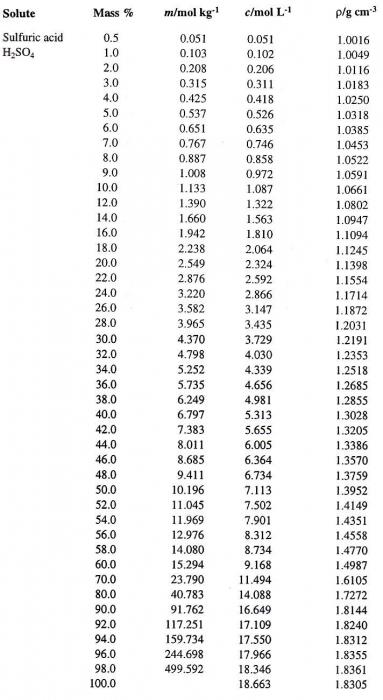
Ela determina o valor desejado, o qual é igual a 1,4987 g / cm 3. Agora calcular a molaridade da solução. Para isso é necessário para determinar a massa de H 2 SO 4 em 1 litro de solução e o número correspondente de moles de ácido.
Volume, que ocupam 100 g de solução de estoque:
100 / 1,4987 = 66,7 mL.
Uma vez que em 66,7 ml de solução a 60% continha 60 g do ácido em 1 litro de ele conterá:
(60 / 66,7) x 1000 = 899, 55 g.
sulfúrico peso molar de ácido igual a 98. Por isso, o número de moles contidos em 899,55 g de seus gramas, será:
899,55 / 98 = 9,18 mol.
A dependência da densidade da concentração de ácido sulfúrico é mostrado na Fig. abaixo. 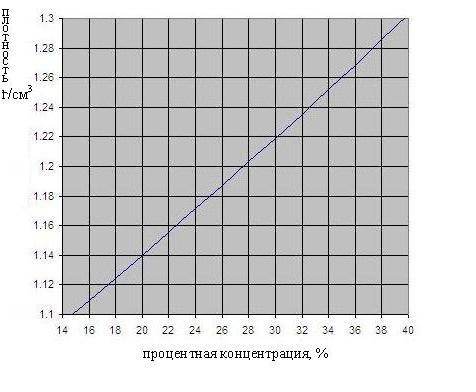
O uso de ácido sulfúrico
Ele é usado em várias indústrias. Na produção de ferro e aço é utilizado para limpar a superfície do metal antes de ser coberta com uma outra substância envolvida na criação de corantes sintéticos, bem como outros tipos de ácidos, tais como ácido clorídrico e nítrico. É também utilizado no fabrico de produtos farmacêuticos, fertilizantes e explosivos, e ainda é um reagente importante na remoção de impurezas a partir do petróleo bruto na indústria de refinação.
Esta química é extremamente útil na vida diária, e é facilmente disponível como uma solução de ácido sulfúrico utilizado em baterias de chumbo-ácido (por exemplo, aqueles que estão em automóveis). Este ácido tem geralmente uma concentração de cerca de 30% a 35% de H 2 SO 4 por peso, o equilíbrio – água.
Para muitas aplicações de consumo de 30% de H 2 SO 4 será mais do que suficiente para satisfazer as suas necessidades. No entanto, na indústria e que exige uma concentração muito mais elevada de ácido sulfúrico. Tipicamente, durante o fabrico é primeiro obtido suficientemente diluído e contaminado com inclusões orgânicos. ácido concentrado é obtido em duas fases: em primeiro lugar, ajustou-se a 70%, e, em seguida, – num segundo passo – é aumentada para 96-98%, que é o parâmetro limitante para a produção economicamente viável.
A densidade do ácido sulfúrico e suas variedades
Apesar de quase 99% de ácido sulfúrico pode ser brevemente ao refluxo, mas subsequente perda de SO3 no ponto de ebulição reduz a concentração de 98,3%. Em geral, as espécies com o índice 98% mais estáveis em armazenamento.
ácidos de grau comercial pode variar na sua concentrao de interesse, e para o qual é seleccionado esses valores em que a temperatura baixa de cristalização. Isto é feito para reduzir a perda de cristais de ácido sulfúrico precipitar durante o transporte e armazenamento. As principais variedades são:
- A torre (nitroso) – 75%. densidade do ácido sulfúrico da classe é igual a 1670 kg / m 3. Obter chamado. método nitroso em que tratado o nitroso resultante (isto é também de H 2 SO 4, mas com óxidos de azoto dissolvidos) no primário disparar o gás contendo dióxido de enxofre calcinada SO 2, em torres revestidas (daí as variedades nome). Como resultado atribuído óxidos de azoto e de ácidos que não são consumidos durante o processo, e retornado para o ciclo de produção.
- Contato – 92,5-98,0%. densidade do ácido sulfúrico de 98% da classe é igual a 1836.5 kg / m 3. É também obtido a partir de gases de torrefacção contendo SO2, em que o processo compreende a oxidação do dióxido de anidrido de SO3 com o seu contacto (daí o nome de grau) com várias camadas de catalisador de vanádio sólido.
- Oleum – 104,5%. A sua densidade é igual a 1896,8 kg / m 3. Esta solução de SO 3 em H 2 SO 4, em que o primeiro componente contém 20%, e ácido – é de 104,5%.
- oleum Alto grau – 114,6%. A sua densidade – 2002 kg / m 3.
- Bateria – 92-94%.
Como é que a bateria do carro
O funcionamento do presente um dos dispositivos eléctricos mais populares baseia-se inteiramente sobre os processos electroquímicos que ocorrem na presença de ácido sulfúrico aquoso.
bateria de automóvel contém diluir electrólito de ácido sulfúrico, e eléctrodos positivos e negativos na forma de várias placas. placas positivas são feitas de um material castanho-avermelhado – de dióxido de chumbo (PbO 2), e negativa – do acinzentado chumbo "esponja" (Pb).
Uma vez que os eléctrodos são feitos de chumbo ou material de chumbo, este tipo de pilha é muitas vezes chamado de baterias de chumbo-ácido. A sua tensão de saída E. A operacionalidade, t. É directamente determinada por aquilo que é neste momento a densidade de ácido sulfúrico (kg / m3 ou g / cm 3), preenchido a bateria como o electrólito.
O que acontece com o eletrólito quando a bateria descarrega,
O electrólito de baterias de chumbo-ácido é uma solução recarregável de ácido sulfúrico em água destilada quimicamente puro com uma concentração de interesse, de 30% em carga completa. ácido líquido tem uma densidade de 1,835 g / cm 3, o electrólito – cerca de 1,300 g / cm 3. Quando a bateria está descarregada, reacções electroquímicas ocorrem resultando no ácido sulfúrico retirados do electrólito. concentração da solução depende quase proporcional à densidade, de modo que deve diminuir devido ao decréscimo na concentração de electrólito.
Enquanto a corrente de descarga flui através do ácido da bateria é amplamente usado perto seus eléctrodos e o electrólito se torna mais diluído. difusão de ácido a partir do volume total de electrólito e as placas de eléctrodos suporta intensidade aproximadamente constante de reacções químicas e, consequentemente, da tensão de saída.
No início do processo de descarga de difusão do electrólito ácido na placa ocorre rapidamente porque o sulfato resultante com poros ainda marcados no material activo dos eléctrodos. Quando sulfato começa a se formar e encher os poros dos eléctrodos, a difusão tem lugar mais lentamente.
Teoricamente, é possível continuar a descarga, desde que todo o ácido não irá ser utilizado, e o electrólito será composta de água pura. No entanto, a experiência mostra que o nível não deve continuar depois a densidade do electrólito caiu para 1,150 g / cm 3.
Quando a densidade diminui de 1,300 a 1,150, o que significa que tanto o sulfato foi formado durante a reacção, e que preenche todos os poros no material activo sobre as placas, ou seja. E. A partir da solução já seleccionado quase todo o ácido sulfúrico. A densidade depende da concentração proporcionalmente, e de forma semelhante, a densidade de carga da bateria depende. Fig. abaixo mostra a dependência da densidade do electrólito das pilhas. 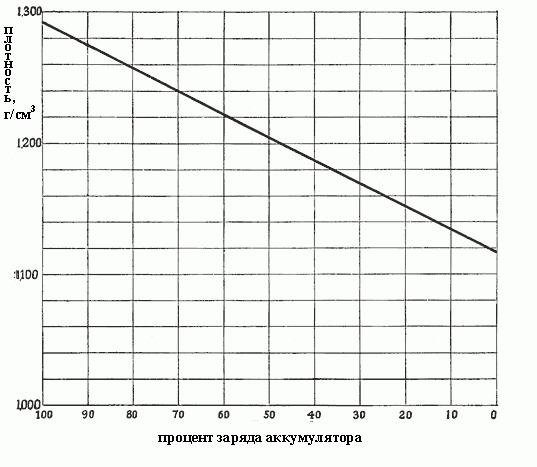
Mudar a densidade do electrólito, a melhor forma de determinar o estado de descarga da bateria, desde que seja adequadamente usado.
Graus de descarga da bateria de carro, dependendo da densidade do eletrólito
A sua densidade deve ser medido a cada duas semanas e devem ser mantidos sempre ler o registro para uso futuro.
O electrólito mais densa, mais ácido que contém e a mais a bateria é carregada. Densidade de 1,300-1,280 g / cm 3 indica uma carga completa. Tipicamente, o grau seguinte de descarga da bateria variam dependendo da densidade do electrólito:
- 1,300-1,280 – totalmente carregada:
- 1,280-1,200 – mais do que metade vazio;
- 1,200-1,150 – cobrado menos da metade;
- 1.150 – quase vazio.
Em uma bateria totalmente carregada antes de ligar a sua tensão de alimentação automóvel de cada célula é 2,5-2,7 V. Assim que a carga está ligado, a tensão cai rapidamente para cerca de 2,1 V por três ou quatro minutos. Isto é devido à formação de uma fina camada de sulfato de chumbo na superfície das placas de eléctrodos negativos, e entre a camada de chumbo e o peróxido de metal placas positivas. O valor final da voltagem da célula depois de uma rede de estradas conectar aproximadamente 2,15-2,18 volts.
Quando a corrente começa a fluir através da bateria durante a primeira hora de operação, há uma queda de tensão de 2 V, devido ao aumento da resistência interna da célula, devido à formação de grandes quantidades de sulfato de que preenche os poros das placas e a selecção do ácido electrólito. Pouco antes do início do fluxo da densidade de corrente do electrólito é máxima e igual a 1,300 g / cm 3. Inicialmente subpressão ocorre rapidamente, mas, em seguida, definir o estado de equilíbrio entre a densidade do ácido perto das placas de eléctrodos e de selecção de volume substancialmente electrólitos suportado ácido entrar novo ácido pedaços a partir da maior parte do electrólito. A densidade média do electrólito continua a diminuir regularmente em relação ao mostrado na Fig. acima. Depois de uma queda de tensão inicial diminui mais lentamente, a sua taxa de redução depende da carga da bateria. processo de descarga de programação de tempo é mostrado na Fig. abaixo. 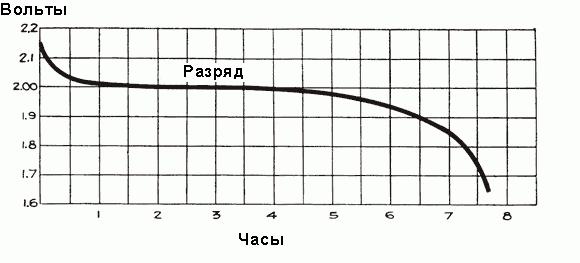
Controlo do estado do electrólito na bateria
Para determinar a densidade de densímetro utilizado. É composto por um tubo de vidro selado com uma extensão na extremidade inferior, preenchido com o mercúrio ou de tiro, e uma escala graduada na extremidade superior. Esta escala rotulada de 1100 a 1300 com vários valores intermédios, como mostrado na Fig. abaixo. Se o hidrômetro é colocado em um eletrólito, ele irá afundar até uma certa profundidade. Assim, vai deslocar um certo volume de electrólito, e quando a posição de equilíbrio é atingido, o peso do volume deslocado será apenas igual ao hidrómetro peso. Uma vez que a densidade do electrólito é igual à razão do seu peso por volume, e o peso do densímetro é conhecida, então cada nível de imersão na solução corresponde a um particular, a sua densidade. 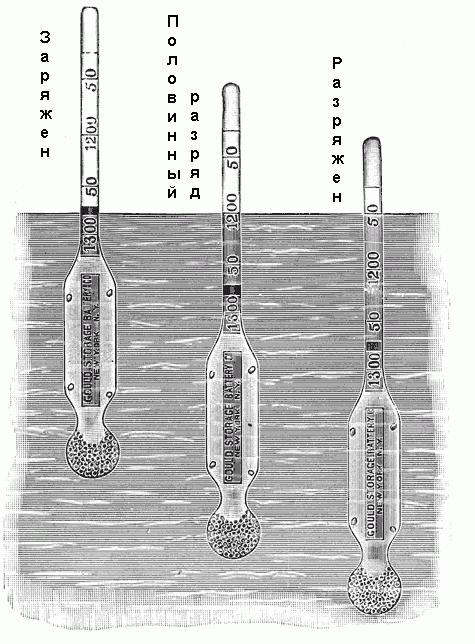 Alguns hidrômetros têm com os valores da escala de densidade, mas são marcados por "Charged", "metade de um dígito", "descarga completa" ou algo semelhante.
Alguns hidrômetros têm com os valores da escala de densidade, mas são marcados por "Charged", "metade de um dígito", "descarga completa" ou algo semelhante.
















