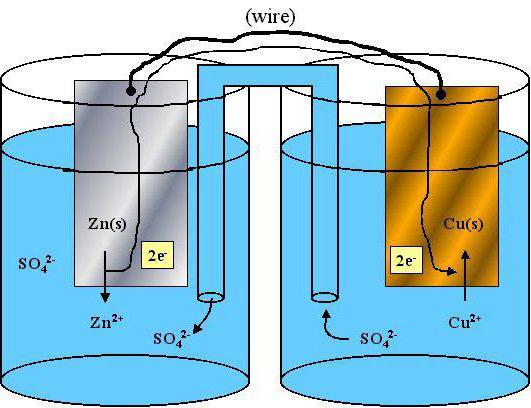
… propriedades redutoras têm propriedades redox
propriedades redox de átomos e iões individuais são um problema importante em química moderna. Este material ajuda a explicar a actividade dos elementos e substâncias para realizar uma comparação detalhada das propriedades químicas dos diferentes átomos.

O que é o agente oxidante
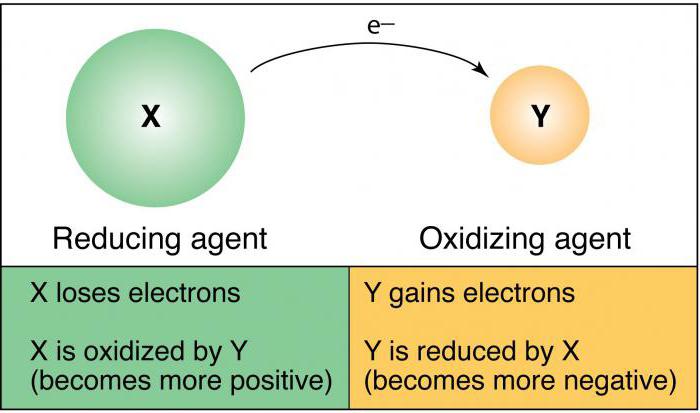
Muitos problemas em química, incluindo perguntas do teste do exame de Estado unificado em grau 11, e JEG no 9º ano, associados a este conceito. O oxidante é considerado átomos ou iões, que, no decurso da interacção química aceitar electrões de outro ião ou átomo. Se analisamos as propriedades oxidantes dos átomos precisa sistema periódico de Mendeleev. No período, que está localizado na mesa da esquerda para a direita, a capacidade de oxidação dos átomos aumenta, isto é, têm as propriedades de um não-metálicos semelhantes. O parâmetro principais subgrupos semelhante diminui para baixo. Entre o mais poderoso de substâncias simples tendo a capacidade de oxidação, conduzem fluoreto. Um termo tal como "electronegatividade", é possível ter um átomo no caso da interacção química dos electrões pode ser considerada sinónimo de propriedades oxidativas. Entre as substâncias complexas que consistem em dois ou mais elementos químicos pode ser considerado oxidantes brilhantes: permanganato de potássio, clorato de potássio, ozono.

Qual é o redutor
Reduzindo propriedades típicas para átomos de substâncias simples que exibem propriedades metálicas. Em períodos da tabela periódica nas propriedades metálicas, deixou enfraquecida, e nos principais subgrupos (vertical), eles são amplificados. A essência da recuperação do impacto dos elétrons, que estão localizados no nível de energia externa. Quanto maior o número de camadas eletrônicas (níveis), o mais fácil de enviar durante a interação química dos elétrons "extra".
Excelentes propriedades redutoras têm metais activos (alcalino, alcalino-terroso). Além disso, as substâncias que exibem parâmetros semelhantes que distinguem o óxido de enxofre (6), o monóxido de carbono. A fim de conseguir o máximo grau de oxidação, os compostos têm de mostrar propriedades redutoras.
O processo de oxidação
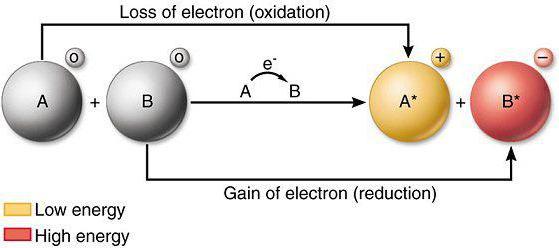
Se, durante a interacção química do átomo ou ião perde electrões a um outro átomo (ião), refere-se ao processo de oxidação. Para uma análise de como alterações que diminuam propriedades e capacidade oxidativa, os elementos da tabela periódica, bem como o conhecimento de leis actuais da física requerida.

processo de recuperação
processos de redução envolvem a adopção de iões ou electrões por átomos de outros átomos (iões) durante interacção química directa. Excelentes agentes redutores são nitritos, sulfitos de metais alcalinos. Reduzindo as propriedades dos elementos do sistema de mudar as propriedades do metal semelhantes a substâncias simples.
Algoritmo de análise OVR
A fim de reação química pronto do aluno para organizar os coeficientes, você deve usar um algoritmo especial. propriedades redox ajudar a resolver uma variedade de tarefas de design na analítica, química orgânica, em geral. Fim oferecer qualquer análise da reação:
- Em primeiro lugar, é importante para definir cada elemento de estado disponível oxidação, usando as regras.
- Próximo definir esses átomos ou iões, que foram alterados seu estado de oxidação, para ser envolvido na reacção.
- Marcas "menos" e "plus" indicam o número do elenco adoptada durante a reação química dos elétrons livres.
- Além disso, entre o número de electrões é determinado pelo mínimo múltiplo comum, isto é, um número inteiro que é divisível por electrões aceites e devolvidas.
- Em seguida, ele é dividido em elétrons que participam nas reações químicas.
- Em seguida, nós determinar exactamente qual os iões ou átomos têm propriedades redutoras, bem como determinar oxidantes.
- Na fase final de coeficientes de pose em Eq.
método de aplicação do saldo eletrônico, para colocar os coeficientes em um determinado esquema de reação:
NaMnO 4 + ácido sulfúrico + sulfureto de hidrogénio = S + Mn SO 4 + … + …
Algoritmo para resolver este problema
Nós descobrir exatamente o que deve ser formada após a interação da matéria. Uma vez que a reacção já está oxidante (que vai de manganês) e definido agente redutor (que será enxofre) formada substância que não está a mudar o grau de oxidação. Uma vez que a reacção principal ocorre entre o sal e o ácido forte contendo oxigénio, então um da substância final será água, e o segundo – o sal de sódio, mais precisamente, o sulfato de sódio.
Voltemos agora esquema ea adoção do elétron:
– Mn +7 leva 5 e = Mn +2.
A segunda parte do regime:
– S -2 = S 0 otdaet2e
Colocamos nas velocidades iniciais de reacção, não esquecendo para resumir todos os átomos de enxofre nos lados da equação.
2NaMnO 4 + 5H 2 S + 3H 2 SO 4 = 5S + 2MnSO 4 + 8H 2 O + Na 2 SO 4.
Analisando OVR que envolve peróxido de hidrogénio
Aplicando a OVR análise de algoritmos pode equiparar a reação química:
peróxido de hidrogénio + ácido sulfúrico + potássio permagnanat = Mn SO 4 + oxigénio + … + …
A oxidação de iões de oxigénio alterado (peróxido de hidrogénio) e catião manganês para permanganato de potássio. Isto é, um agente redutor e um agente oxidante, estamos presentes.
Definir o que é um material ainda pode acontecer após a interação. Um deles é a água, que é, obviamente, representado pela reacção entre o ácido e o sal. O potássio não formar uma nova substância, o segundo produto sal de potássio, ou seja, sulfato, como a reacção prosseguiu com ácido sulfúrico.
condução:
2O – 2 dá electrões e transformado em ó 2 0 5
Mn 7 5 recebe electrões e torna-se um ião de Mn + 2 2
Colocamos taxas.
5H 2 O 2 + 3H 2 SO 4 + 2KMnO = 5O 2 4 + 2Mn SO 4 + 8H 2 O + K 2 SO 4
EXEMPLO análise OVR com cromato de potássio
Usando o método de balança eletrônica, estabelecer uma equação com coeficientes:
FeCl2 + Ácido clorídrico + potássio cromato = FeCl3 + CrCl 3 + … + …
ferro mudado estado de oxidação (cloreto de ferro em II) e de iões de crómio no bicromato de potássio.
Agora vamos tentar descobrir o que outras substâncias são formadas. Um pode ser um sal. Como potássio não é formado qualquer composto, assim, o segundo produto é um sal de potássio, mais precisamente, cloreto, porque a reacção realizou-se com ácido clorídrico.
Para traçar:
Fe +2 envia e = Fe 3 6 redutor
2cr 6 6 recebe e = 2cr 3 um oxidante.
Nós representam os coeficientes da reação inicial:
6K 2 Cr 2 O 7 + FeCl2 + 14HCl = 7H 2 O + 6FeCl 3 + 3 + 2CrCl 2KCl
EXEMPLO análise OVR com iodeto de potássio
Armado com as regras, estabelecer uma equação:
permanganato de potássio + iodeto de potássio + ácido sulfúrico, sulfato de manganês + … iodo + … + …
O estado de oxidação alterada manganês e iodo. Que é o redutor e oxidante estão presentes.
Agora nós descobrimos no final temos formado. O composto terá de potássio, isto é, obter o sulfato de potássio.
processos de redução ocorrer nos iões de iodo.
Formar o esquema de transferência de electrões:
– Mn 7 5 recebe e = Mn 2 2 é um agente oxidante,
– 2I – dá E = I 2 2 0 5 é um agente redutor.
Nós providenciar os coeficientes na reacção inicial, enquanto não se esqueça de sintetizar todos os átomos de enxofre na equação.
210KI + KMnO4 + 8H 2 SO 4 = 2MnSO 4 + 2 + 5I 6K 2 SO 4 + 8H 2 O
EXEMPLO análise OVR com sulfito de sódio
Usando o método clássico, nós elaborar esquemas para a equação:
– Ácido sulfúrico + KMnO 4 + … sulfito de sódio, sulfato de sódio, sulfato de manganês + … + … +
Após a reacção de obtenção de água de sal de sódio.
Para traçar:
– Mn 7 5 recebe e = Mn 2 2
– S 4 2 envia e = S +6 5.
Nós organizar os coeficientes nesta reacção, não é se esqueça de colocar os átomos de enxofre na definição de coeficientes.
3H 2 SO 4 + 4 + 5Na 2KMnO 2 SO 3 = K 2 SO 4 + 4 + 5Na 2MnSO 2 SO 4 + 3H 2 O.
EXEMPLO análise OVR com azoto
Concluir as seguintes tarefas. Usando o algoritmo, que formam uma equação de reação completa:
– nitrato de manganês + ácido nítrico + PbO 2 = HMnO 4 + Pb (NO3) 2 +
Vamos analisar o que substância até mesmo formas. Uma vez que a reaco foi realizada entre um forte agente oxidante e sal, em seguida, a substância é água.
Vamos mostrar a mudança no número de elétrons:
– Mn 2 5 envia e = Mn 7 2 apresenta as propriedades de um agente de redução,
– Pb 4 2 recebe de e = Pb 2 5 oxidante.
3. providenciar os coeficientes na reacção inicial, cuidadosamente adicionar-se todo o azoto presente no lado esquerdo da equação inicial:
– 2Mn (NO3) 2 + 3 + 6HNO 5PbO 2 = 2HMnO 4 + 5PB (NO3) 2 + 2H 2 O.
Nesta reacção, propriedades redutoras não são manifestados azoto.
Uma segunda amostra da reacção redox com azoto:
Zn + ácido sulfúrico + HNO 3 = ZnSO 4 + NO + …
– Zn 0 2 envia e = Zn + 2 3 ser agente de redução,
N 5 3 recebe e = N 2 2 é o oxidante.
Colocam-se os coeficientes de uma reacção predeterminada:
3Zn + 3H 2 SO 4 + 3 = 2HNO 3ZnSO 4 + 2NO + 4H 2 O.
O significado das reacções redox
A reacção mais conhecido redução – fotossíntese, uma planta típica. Como alterar as propriedades de recuperação? O processo ocorre na biosfera, ela conduz a um aumento de energia com uma fonte externa. É esta energia e usa para suas necessidades da humanidade. Exemplos de oxidação e redução reacções associadas com elementos químicos, são de particular importância a conversão de compostos de azoto, carbono, oxigénio. Através da fotossíntese atmosfera da Terra tem uma tal composição que é necessário para o desenvolvimento de organismos vivos. Através da fotossíntese não aumentar o dióxido de carbono na caixa de ar, a superfície da Terra não está sobreaquecido. A planta se desenvolve, não só através de uma reacção redox, mas as formas de tais substâncias para os seres humanos, tais como o oxigénio, a glicose desejado. Sem esta reacção química pode não ser um ciclo cheio de matéria na natureza, bem como a existência de vida orgânica.
aplicação prática OVR
A fim de manter a superfície de metal, é necessário saber que têm propriedades redutoras metais activos, por conseguinte, é possível cobrir a camada de superfície sobre o elemento activo, retardando assim o processo de corrosão química. Devido às propriedades redox de limpeza e desinfecção de água potável. Nem um problema não pode ser resolvido sem ter colocado corretamente nos coeficientes da equação. Para evitar erros, é importante ter uma idéia sobre todos os parâmetros redox.
A protecção contra a corrosão química
Desafio particular à vida e à atividade humana é a corrosão. Como resultado da conversão química de falha de metal, perdendo suas peças do carro de desempenho, máquinas-ferramentas. A fim de corrigir uma tal problema, usando protecção de sacrifício, uma camada de revestimento de metal de verniz ou tinta aplicando ligas anticorrosivos. Por exemplo, a superfície do aço é coberta com uma camada de metal activo – alumínio.
conclusão
Uma variedade de reacções de redução ocorrem no corpo, assegurar o funcionamento normal do sistema digestivo. Tais processos de vida básicos como a fermentação, a putrefacção, respiração, também associada com propriedades redutoras. Têm características semelhantes, todas as criaturas vivas em nosso planeta. Sem reacção com dedicação e aceitação de electrões não pode ser extracção, produção industrial de amoníaco, álcalis, ácidos. Em todas as técnicas de química analítica análise volumétrica é baseado nos processos redox. Lutar com tal fenómeno desagradável de corrosão química, também é baseado no conhecimento destes processos.