Os compostos de azoto. Propriedades de azoto
Dar à luz nitrato – como traduzido do latim Nitrogenium. Este azoto título – elemento químico com um número atómico de 7, a cabeça 15 th grupo na versão longa da tabela periódica. Sob a forma de uma substância simples composto da terra distribuído saco de ar – atmosfera. Uma variedade de compostos de nitrogênio encontrado na crosta da terra, e os organismos vivos são amplamente utilizados em indústrias, militar, agricultura e medicina.
Por que é azoto, chamado de "asfixia" e "sem vida"
Como os historiadores da química sugerem primeiro tenho essa substância simples Henry Cavendish (1777). Scientific passa ar sobre brasas para absorção dos produtos reaccionais utilizando álcali. Como resultado da experiência pesquisador encontrou gás incolor e inodoro, carvão que não reagiu. Cavendish chamado "ar sufocação" para a incapacidade de manter a respiração e combustão.
Química moderna ser explicado que o oxigénio reage com o carvão, o dióxido de carbono é formado. Os restantes "abafado" do ar foi para a maior parte das moléculas de N 2. Cavendish e outros cientistas do tempo sobre este assunto não é ainda conhecida, embora os compostos de azoto e nitrato, em seguida, foram amplamente usados na economia. O cientista contou sobre o gás incomum a um colega para realizar experimentos semelhantes – Joseph Priestley.
Ao mesmo tempo, Carl Scheele chamou a atenção para o componente desconhecido do ar, mas não conseguiu explicar adequadamente a sua origem. Apenas Daniel Rutherford em 1772 percebeu que as presentes experiências "abafado" "estragado" gás – de azoto. Alguns cientistas acreditam que o seu descobridor – ainda é debater os historiadores da ciência.

15 anos após os experimentos de Rutherford famoso químico Antuan Lavuaze proposto para substituir o ar termo "estragado" refere-se ao nitrogênio, por outro – Nitrogenium. No momento em que foi provado que esta substância não queima, não suporta respiração. Em seguida, houve o russo nome "nitrogênio", que é interpretado de maneiras diferentes. Costumo dizer que o termo significa "sem vida". Estudos posteriores refutaram a crença generalizada sobre as propriedades das substâncias. compostos de azoto – – proteínas as principais macromoléculas na composição de organismos vivos. De modo a construir as plantas absorvem a partir dos elementos necessários nutrição mineral do solo – 2- iões NO3 e NH4 +.
Azoto – um elemento químico
Para entender a estrutura atômica e propriedades ajuda do sistema periódico (PS). A posição do elemento químico na tabela periódica pode definir carga nuclear, número de protões e neutrões (número de massa). É necessário prestar atenção ao valor da massa atômica – esta é uma das principais características do elemento. período, o número corresponde ao número de níveis de energia. A versão curta do número da tabela periódica Grupo corresponde ao número de electrões no nível energaticheskom externo. Resumindo os dados nas características gerais de azoto por sua posição no sistema periódico:
- Este é um elemento não-metálico é, no canto superior direito da SS.
- símbolo químico: N.
- número de propriedade: 7.
- massa atômica relativa: 14,0067.
- Os compostos de fórmula de hidrogénio voláteis: NH3 (amónia).
- Formas uma maior óxido de N 2 O 5, o que é igual à valência de V. azoto
átomo de azoto estrutura:
- carga nuclear +7.
- O número de protões: 7; o número de neutrões: 7.
- Número de níveis de energia: 2.
- O número total de electrões: 7; e fórmula: 1s 2s 2 2 3 2p.
Detalhes estudado isótopos estáveis № elemento 7, os seus números de massa – 14 e 15. O conteúdo de um átomo de luz dos quais é 99,64%. Os núcleos de isótopos radioactivos de vida curta é também 7 protões, e número de neutrões varia grandemente: 4, 5, 6, 9, 10.
Nitrogênio na natureza
Como parte das moléculas de ar estão presentes bainha de terra substância simples, cuja fórmula – N 2. O teor de gás de azoto na atmosfera é de cerca de 78,1% em volume. compostos inorgânicos do elemento químico na crosta terrestre – vários sais de amónio e nitratos (nitro). Os compostos da fórmula e os nomes de algumas das substâncias mais importantes:
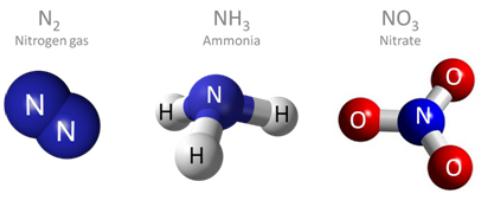
- NH 3, amoníaco.
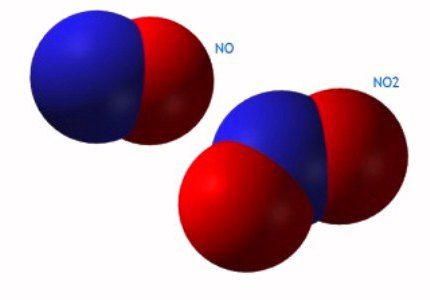
- NÃO dióxido de 2, azoto.
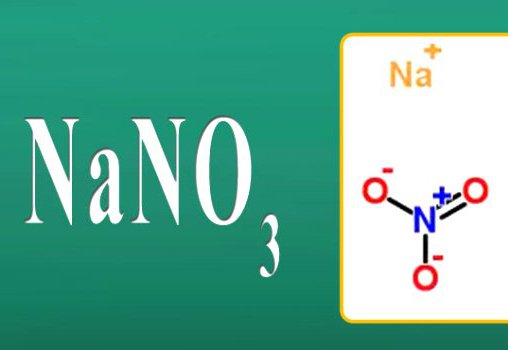
- NaNO 3 Nitrato de sódio.
- (NH 4) 2 SO 4, sulfato de amónio.
A valcia do azoto nos dois últimos compostos – IV. Carvão, solo, organismos vivos também conter átomos de azoto, em forma ligada. O azoto é um componente de aminoácidos macromoléculas, ADN e nucleótidos de ARN, hormonas e hemoglobina. O teor total do elemento químico no corpo humano atinge 2,5%.
substância simples
O azoto na forma de moléculas diatómicas – o maior volume e peso do ar ambiente. Substância, cuja fórmula é N 2, não tem odor, cor e sabor. Este gás é mais do que 2/3 terra ar bainha. O nitrogénio líquido é uma substância incolor, assemelha-se a água. Ferve a uma temperatura de -195,8 ° C. H (N2) = 28 g / mol. Simples substância pouco mais fácil de oxigénio, azoto, ar, a sua densidade é próxima de 1.
Os átomos na molécula se ligam firmemente 3 partilhada pares de electrões. O composto apresenta uma elevada resistência a produtos químicos, o que o distingue de oxigénio e outras substâncias gasosas. Para uma molécula de nitrogénio é dividido em seus átomos constituintes necessário despender energia 942,9 kJ / mol. Contacto dos três pares de electrões é muito forte, começa a romper-se quando aquecido a mais de 2000 ° C.
praticamente não ocorre em condições normais, a dissociação das moléculas em átomos. inércia química também é causada por azoto completa ausência de polaridade na sua molécula. Eles interagem muito fracamente com a outra, funcionando, assim, o estado gasoso da matéria, à pressão normal e a uma temperatura próxima da temperatura ambiente. actividade química baixo de azoto molecular é usada em diferentes processos e dispositivos em que é necessário para criar um ambiente inerte.
A dissociação das moléculas de N 2 pode ocorrer sob a influência de radiação solar na atmosfera superior. azoto atómico é formado, que reage com certos metais e não metais sob condições normais (fósforo, enxofre, arsénico). O resultado é a síntese das condições do solo substâncias que são obtidas indirectamente.

valência azoto
O invólucro exterior de electrões do átomo de formar um electrão 2 s 3 e p. Estes azoto negativo pode dar partículas ao interagir com outros elementos que correspondem às suas propriedades redutoras. Adjacente ao octeto faltando a 3 átomos de electrões exibe capacidade oxidativa. Electronegatividade azoto abaixo suas propriedades metálicas são menos pronunciada do que a de flúor, oxigénio e cloro. Ao interagir com estes elementos químicos azoto dá electrões (oxidar). Redução de iões negativos, seguido por reacção com outros metais e não metais.
valência azoto típico – III. Neste caso, as ligações químicas são formados pela p-atracção de electrões exterior e a criação de comum (ligação) par. O azoto é capaz de formação de ligação doador-aceitador devido ao seu par de electrões, como é o ião de amónio NH4 +.
Obtendo no laboratório e na indústria
Uma métodos laboratoriais com base em propriedades oxidativas de óxido de cobre. Use composto de azoto com hidrogénio – amoníaco NH3. Este desagradável cheiro vzaimoddeystvuet gás com pó de óxido de cobre preto. A reacção resultante produz azoto e aparece cobre metálico (pó vermelho). Depositado sobre as paredes do tubo waterdrops – um outro produto da reacção.
Outro método de laboratório, que utiliza um composto de azoto com metais – azida, por exemplo NaN3. Obtido por um gás que não precisam ser limpos de contaminantes.
O laboratório é levada a decomposição de nitrito de amónio para azoto e água. Para iniciar a reacção, o aquecimento é necessário, então o processo prossegue com a libertação de calor (exotérmica). O azoto é contaminado com impurezas, por isso, é limpo e seco.
Preparação do azoto na indústria:
- destilação fraccionada de ar líquido – um método, que utiliza as propriedades físicas de azoto e oxigénio (ponto de ebulição diferente);
- reacção química do ar com um carvão quente;
- separação de gás de adsorção.
Interacção com metais e de hidrogénio – propriedades oxidantes
O inércia moléculas duráveis não permitir alguma síntese directa dos compostos de azoto. Para activar os átomos necessários para aquecimento forte ou substância irradiação. Azoto pode reagir com lítio à temperatura ambiente, com o magnésio, de cálcio e de sódio, a reacção realiza-se apenas por aquecimento. Nitretos metálicos correspondentes são formados.
A interacção do azoto com hidrogénio realiza-se a alta temperatura e pressão. Além disso, este processo requer o catalisador. Amoníaco obtido – uma da síntese química mais importante. Azoto, como agente oxidante, apresenta nos seus estados de oxidação negativos tri:
- 3 (compostos de amónia e outro azoto, hidrogénio – nitretos);
- -2 (de hidrazina N 2 H 4);
- -1 (hidroxilamina NH2OH).
O nitreto de mais importante – Amônia – preparado em grandes quantidades na indústria. O grande problema para um longo período de tempo manteve-se a inércia química do azoto. Suas fontes de matérias-primas foram nitrato, mas reservas minerais começou a declinar rapidamente com o crescimento da produção.

A grande conquista da ciência e da prática química tem sido a criação de técnica de fixação de nitrogênio amoniacal em escala industrial. Em colunas especiais é por síntese directa – um processo reversível entre o azoto obtido a partir do ar e do hidrogénio. Ao criar condições óptimas, desloca o equilíbrio desta reacção para o lado do produto, utilizando o catalisador de rendimento de amoníaco é de 97%.
De interacção com o oxigénio – propriedades redutoras
A fim de iniciar a reacção de azoto e oxigénio, deve ser forte aquecimento. Possuir energia suficiente arco elétrico e uma descarga atmosférica para a atmosfera. Os compostos inorgânicos mais importantes em que o azoto se encontre na seus estados de oxidação positivos:
- 1 (óxido de azoto (I) N 2 O);
- 2 (NÃO de monóxido de azoto);
- 3 (óxido de azoto (III) N 2 O 3, HNO2 ácido nitroso, sais de nitrito dos mesmos);
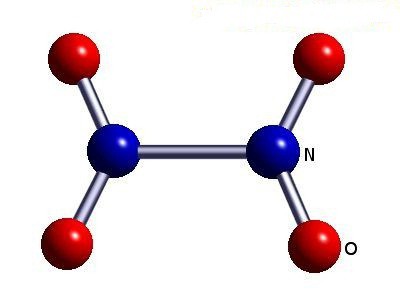
- 4 (dióxido de azoto (IV) NO 2);
- 5 (pentóxido de azoto (V) N 2 O 5, HNO3 ácido nítrico, nitratos).
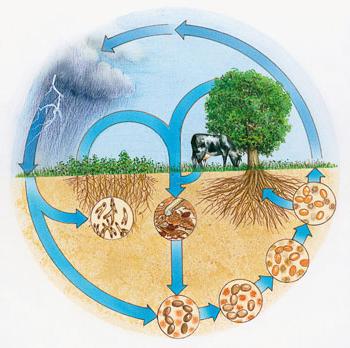
O valor de ocorrência natural
As plantas absorvem iões de amónio e aniões de nitrato do solo utilizado para a síntese de reacções químicas de moléculas orgânicas nas células funcionando constantemente. bactérias do nódulo de azoto atmosférico pode assimilar – entidades microscópicas formando nódulos nas raízes das leguminosas. Como resultado, este grupo de plantas recebeu a bateria exigido, que enriquece o solo.
Durante tempestades tropicais ocorrer a reacção de oxidação do azoto atmosférico. Os óxidos são dissolvidos para formar ácidos, estes compostos de azoto entrar no solo na água. Devido ao ciclo de elementos da natureza estão constantemente reabastecido suas reservas na crosta da terra, do ar. moléculas orgânicas complexas contendo azoto na sua composição, são degradados por bactérias sobre os componentes inorgânicos.
uso prático
Os compostos de azoto mais importantes para a agricultura – um sal altamente solúvel. Absorvido pelas plantas ureia nitrato (sódio, potássio, cálcio), compostos de amónio (água de amónia, cloreto, sulfato, nitrato de amónio).
Inerte azoto propriedades plantas incapacidade de absorver a partir do chumbo para fora a necessidade de fazer grandes doses anualmente nitratos. Partes do organismo vegetal é capaz de armazenar energia macrocell "para o futuro", que degrada a qualidade do produto. O excesso de nitratos em vegetais e frutas podem causar intoxicação em seres humanos, o crescimento de tumores malignos. Para além da agricultura, os compostos de azoto são usados em outras indústrias:
- para a preparação de medicamentos;
- para a síntese química de compostos de elevado peso molecular;
- no fabrico de explosivos de trinitrotolueno (TNT);
- para a produção de corantes.
NÃO óxido encontra utilização em cirurgia, a substância tem um efeito analgésico. Perda de sensibilidade quando o gás inalado notou que até os primeiros pesquisadores o nitrogênio propriedades químicas. Portanto, não era um nome comum "gás hilariante".
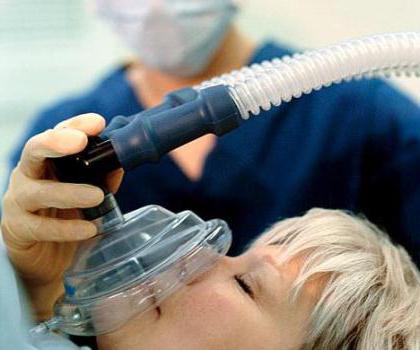
O problema de nitratos nos produtos agrícolas
Os sais de ácido nítrico – Nitrato – continha um anião de carga única NÃO 3-. Ainda utilizado o antigo nome do grupo de substâncias – nitrato de amónio. Nitratos são usados para fertilizar os campos, em estufas, jardins. Trazê-los no início da primavera antes do plantio, no verão – na forma de alimentos líquidos. Por si só, a substância não representa um grande perigo para as pessoas, mas no corpo, eles são convertidos em nitritos, em seguida, em nitrosaminas. Nitrito Não 2- iões – partículas tóxicas, que provocam a oxidação de ferro ferroso nas moléculas de hemoglobina nos iões trivalentes. Neste estado, o principal substância de sangue humano e animal não é capaz de transportar oxigénio e remover o dióxido de carbono a partir dos tecidos.
A contaminação por nitratos mais perigoso dos alimentos para a saúde humana:
- tumores malignos resultantes da conversão dos nitratos de nitrosaminas (carcinogénico);
- o desenvolvimento de colite ulcerativa,
- hipotensão ou hipertensão;
- insuficiência cardíaca;
- distúrbios hemorrágicos
- lesões do fígado, o pâncreas e o desenvolvimento de diabetes;
- desenvolvimento de insuficiência renal;
- anemia, diminuição da memória, atenção e inteligência.
A utilização simultânea de diferentes produtos com grandes doses de nitratos leva a intoxicação aguda. As fontes podem ser plantas, água potável, pratos de carne prontas. Imersão em água limpa e cozinhar pode reduzir o teor nutricional dos produtos de nitrato. Os investigadores verificaram que a doses mais elevadas de compostos perigosos observados na produção imaturo e planta de estufa.

Fósforo – elemento grupo do nitrogênio
Átomos de elementos químicos que estão na mesma coluna vertical do sistema periódico, exibem propriedades comuns. O fósforo está localizado no terceiro período, ele refere-se ao grupo 15, bem como de azoto. elementos de estrutura de átomos semelhantes, mas há diferenças nas propriedades. Azoto e fósforo exibem negativo valência e estado de oxidação III nos seus compostos com metais e hidrogénio.
Muitas reações de fósforo processar a temperaturas normais, um elemento quimicamente ativa. É feito reagir com oxigénio para formar P 2 O 5 mais elevada de óxido. A solução aquosa deste material tem as propriedades de ácido (metafosfórico). Durante o aquecimento o ácido ortofosfórico é obtido. Ela define uma pluralidade de tipos de sais, muitos dos quais são os fertilizantes minerais, por exemplo superfosfatos. compostos de azoto e fósforo formam uma parte importante do ciclo de matéria e energia em nosso planeta, utilizado em campos industriais, agrícolas e outras.