Molécula: um peso molécula. O tamanho e a massa das moléculas
A composição de materiais complexos, embora eles são formados por partículas minúsculas – átomos, moléculas, iões. A estrutura molecular tem muitos líquidos e gases, bem como um corpo sólido. Os átomos e iões de metais compreendem, muitos sais. Todas as partículas têm massa, mesmo a molécula mais ínfimo. Massa da molécula, se expressar em Kilos, recebe um valor muito pequeno. Por exemplo, m (H2O) = 30 • 10 -27 kg. Tais características importantes de uma substância como o peso e as dimensões das micropartículas, tem sido estudado físicos e químicos. As bases foram lançadas nas obras de Mikhail Lomonosov e Dzhona Daltona. Considere como mudou desde pontos de vista sobre o microcosmo.
apresentação Universidade de "corpúsculos"
A suposição da discreta estrutura da matéria expressa por estudiosos da Grécia antiga. Em seguida, ele foi dado o nome de "átomo" a menor partícula indivisível de corpos, "blocos de construção" do universo. O grande estudioso russo M. V. Lomonosov escreveu sobre a física insignificante e indivisível significa estrutura de partícula da matéria – corpuscle. Mais tarde, nos escritos de outros estudiosos, ela foi chamada de "molécula".
molécula de massa e as suas dimensões são determinadas pelas propriedades dos seus átomos constituintes. Durante muito tempo, os cientistas não têm sido capazes de olhar mais profundo sobre o microcosmo que prejudicou o desenvolvimento da química e da física. Lomonosov pediu repetidamente colegas para aprender e no seu trabalho com base em dados quantitativos precisos – uma "medida e peso." Através do trabalho de químico russo e físico lançou as bases da doutrina da estrutura da matéria, que se tornaram uma parte integrante da teoria atômico-molecular coerente.

Átomos e moléculas – "blocos de construção do universo"
Mesmo microscopicamente pequenos objetos difíceis de encontrar, eles têm propriedades diferentes. Partículas, tais como átomos, formadas pelo núcleo e camadas electrónicas diferem no número de cargas positivas e negativas raio peso. Os átomos e moléculas existir na composição de substâncias, não isoladamente, eles são atraídos para força diferente. efeito mais notável das forças atrativas em sólidos, mais fraco – em líquidos, dificilmente sentida nas substâncias gasosas.
As reacções químicas não são acompanhadas por átomos de destruição. Na maioria das vezes, não há um reagrupamento deles, há uma outra molécula. molécula de massa depende do que os átomos que é formado. Mas com todas as mudanças nos átomos são quimicamente indivisível. Mas eles podem se tornar parte de moléculas diferentes. Os átomos de reter as propriedades do elemento ao qual a. Molécula antes de decair em átomos retém todos os atributos de substância.
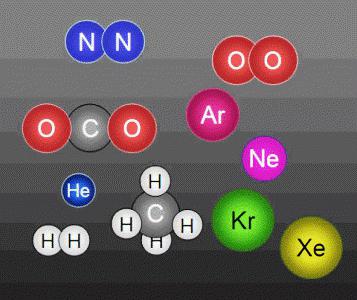
estrutura de micropartículas de corpos – a molécula. massa da molécula
Para medir os macrocorpos massa dispositivos são utilizados, o mais antigo dos quais – escalas. O resultado da medição é convenientemente preparado em kg, como a unidade de base de grandezas físicas do sistema internacional (SI). Para determinar a massa molecular, em quilogramas, é necessário estabelecer os seus pesos atómicos com base no número de partículas. Por conveniência, uma unidade especial da massa foi introduzida – nuclear. Você pode escrevê-lo na forma de carta abreviaturas (amu). Esta unidade corresponde a um doze avos da massa do nuclídeo de carbono 12 C.
Se expressar o valor encontrado em unidades padrão, obtemos 1,66 • 10 -27 kg. Essas pequenas indicadores para os órgãos de massa operam principalmente física. O artigo é uma tabela a partir do qual você pode aprender o que são as massas dos átomos de certos elementos químicos. Para descobrir o que é a massa de uma molécula de hidrogênio em quilogramas, multiplique por dois mostrados na tabela a massa atômica do elemento químico. O resultado é um valor de peso moléculas que consistem de dois átomos.
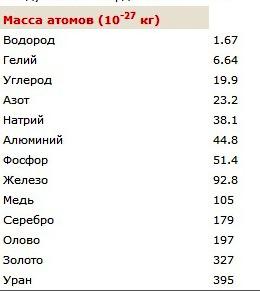
massa molecular relativa
É difícil de operar no cálculo das quantidades muito pequenas, é inconveniente, leva à demorado e sujeito a erros. Quanto ao peso das micropartículas, em seguida, a libertação da situação difícil era a utilização de valores relativos. Familiar para os químicos prazo consiste em duas palavras – "massa atômica", seu símbolo – Ar. conceito idêntico foi introduzido com o peso molecular (o mesmo que a massa da molécula). A fórmula relacionando as duas quantidades: Mr = m (um alvo) / 1/12 m (12 C).
Muitas vezes você pode ouvir o que eles dizem "peso molecular". Este termo obsoleto usado mesmo no que diz respeito ao peso molecular, mas com menor frequência. O fato de que o peso – é uma quantidade física diferente – o poder dos quais depende das coordenadas geográficas do corpo. Em contraste, a massa é uma característica constante das partículas que participam em processos químicos, e são movimentados a uma velocidade normal.

Como para determinar o peso molecular
A definição exacta do peso molecular é realizada pelo instrumento – espectrômetro de massa. Para resolver os problemas, você pode usar as informações da tabela periódica. Por exemplo, a massa de uma molécula de oxigénio é duas • 16 = 32. Nós realizar cálculos simples e encontrar o valor de Mr (H2O) – peso molecular relativo de água. Por Tabela Periódica é definido que a massa de oxigénio – 16, o hidrogénio – 1. desenhar simples cálculos: H R (H 2 O) = 1 + 2 • 16 = 18, em que M r – peso molecular, H2O – molécula de água, H – hidrogénio símbolo elemento ó – sinal de oxigénio químico.
massas dos isótopos
Os elementos químicos na natureza e tecnologia de existir na forma de várias espécies de átomos – isótopos. Cada um deles tem um peso individual, o seu valor não pode ser um valor fracionário. No entanto, o peso atómico do elemento químico frequentemente é um número com vários sinais após a ponto. Quando os cálculos levam em conta a prevalência de cada espécie na crosta da Terra. Por conseguinte, a massa dos átomos da tabela periódica não são necessariamente inteiros. Usando esses valores para cálculos, temos a massa das moléculas, que também não são inteiros. Em alguns casos, pode ser um valor de arredondamento.
O peso molecular da estrutura não-molecular da matéria
A maioria dos compostos inorgânicos não são estrutura molecular. Os metais são compostos de átomos, iões e electrões livres, sais – de catiões e aniões. Para substâncias estruturas de peso não-moleculares também contado moléculas condicionais de fórmula bruta, reflectindo a estrutura mais simples. Encontramos Mr valor para a estrutura substâncias iônicos – sal cuja fórmula NaCl. M r = 23 + 35,5 = 55,5. Para alguns tipos de cálculos necessários massa molecular de ar – mistura de gás. Considerando a percentagem das diferentes substâncias na atmosfera, o molecular de massa do ar é de 29.
O tamanho e a massa das moléculas
Eletromicrografias de moléculas grandes podem considerar os átomos individuais, mas eles são tão pequenos que um microscópio comum não pode ser visto. tamanho de partícula linear de qualquer substância, tal como o peso, – uma característica constante. O diâmetro da molécula depende do raio dos seus átomos constituintes, a sua atracção mútua. Os tamanhos das partículas variam com o número de protões e de níveis de energia. átomo de hidrogénio – o mais pequeno em tamanho, o seu raio é apenas 0,5 • 10 -8 átomo cm urânio é três vezes mais átomos de hidrogénio .. Estes "gigantes" do microcosmos – as moléculas de substâncias orgânicas. Assim, um da dimensão linear da partícula de proteína é de 44 • 10 -8 cm.
Para resumir: a massa de moléculas – é a soma das massas dos átomos dentro deles. O valor absoluto em kg pode ser obtida multiplicando o peso molecular encontrada na Tabela Periódica, o montante 1,66 • 10 -27 kg.
As moléculas são insignificantes em comparação com as macro-corpos. Por exemplo, no tamanho da molécula de água H2O dá o maçã como muitas vezes, quantas vezes este fruto é menor do que o nosso planeta.














