fórmula molecular e estrutural de fenol
Fenóis – o nome comum dos álcoois aromáticos. Sobre as propriedades da matéria são ácidos fracos. Um significado prático importante são muitas homólogos hidroxibenzeno C 6 H 5 0H (fórmula Fenol) – representante mais simples da classe. Vamos examinar isso com mais detalhes.
Fenóis. A fórmula geral e classificação
A fórmula geral das substâncias orgânicas de álcoois aromáticos, – R-OH. própria molécula de fenóis e cresóis radical formado – C6H5 fenilo, que está directamente ligado a um ou mais grupos hidroxilo (OH) grupos hidroxilo. Por seu número por fenóis molécula são classificados em mono, di e poli-hídrico. compostos monofuncionais deste tipo são fenol e cresol. A mais comum entre hydroxybenzenes polihídricos – naftóis que contêm na sua composição 2 núcleo fundido.
Fenol – o representante de álcoois aromáticos
trabalhadores têxteis fenol já era conhecido no século XVIII: os tecelões usou-o como um corante. Na destilação de alcatrão de hulha, em 1834, na Alemanha, o químico F. Runge destaque cristais da substância com um odor doce característico. O carvão nome latino – carbo, assim chamado composto ácido carbólico (ácido carbólico). Pesquisadores alemães não conseguiram identificar a substância. fenol fórmula molecular foi estabelecida em 1842 O. Laurent, que acreditava derivado carbólico de benzeno. Para o novo ácido utilizado o nome de "fenilo". Sharl Zherar determinado que a substância é álcool, e chamado o fenol. As aplicações iniciais compostos – medicina, curtimento de couro, produção de corantes sintéticos. Características da substância em estudo:
- Racional fórmula química – C 6 H 5 OH.
- O peso molecular do composto – e 94,11. e. m.
- A fórmula bruta do agregado, – C 6 H 6 O.

estrutura electrónica e espacial de uma molécula de fenol
estrutura cíclica de fórmula benzeno oferecido pelo alemão orgânico químico F. Kekule em 1865, e pouco antes de ela – I. Loschmidt. Os cientistas têm uma molécula de matéria orgânica na forma de um hexágono regular com a alternância de ligações simples e duplas. De acordo com os conceitos modernos, o anel aromático – um tipo especial de estrutura circular, chamada "ligação conjugada".
Seis átomos de carbono testar processo sp 2 -hybridization orbitais de electrões. Não envolvidos na formação de ligações C-C das nuvens de electrões p-sobrepõem acima e abaixo do plano do núcleo molécula. Há dois nuvem de elétrons comum que cobre todo o anel. Fenol fórmula estrutural podem ser diferentes, dado a abordagem histórica para a descrição da estrutura de benzeno. A fim de realçar o carácter de hidrocarbonetos aromáticos insaturados, convencionalmente considerado três das seis ligações duplas que alternam com três simples.
Polarização devido ao grupo oxi
No mais simples hidrocarboneto aromático – benzeno, C 6 H 6 – nuvem de electrões é simétrico. fórmula fenol difere por um grupo hidroxi. A presença de hidroxilo quebra a simetria que se reflecte nas propriedades da substância. A relação entre o oxigénio e hidrogénio em um grupo hidroxi – covalente polar. Deslocamento par comum de electrões para o átomo de oxigénio conduz a uma mesma carga negativa (parcial). Hidrogênio perde elétrons e adquire uma carga parcial "+". Além disso, o oxigénio do grupo O-H é o proprietário de dois pares de electrões não partilhados. Um deles atraídos pela nuvem de electrões do anel aromático. Por esta razão, a comunicação torna-se mais polarizadas, hidrogênio facilmente substituído metais. Os modelos dão uma idéia da natureza assimétrica da molécula de fenol.
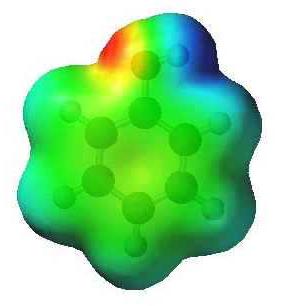
Características átomos de interferência em fenol
Uma nuvem de electrões dos núcleos aromáticos na molécula de fenol reage com um grupo hidroxilo. Ocorre fenómeno, nome de conjugação, em que um par próprio átomo de oxigénio de electrões atraídos para os grupos hidroxi de um sistema de anel de benzeno. Reduzindo a carga negativa compensada por uma maior polarização devido ao grupo O-H.
O anel aromático também varia sistema de distribuição electrónica. Ele é reduzida pelo carbono que está ligado a oxigénio, e é aumentada em mais próximo da mesma átomos nas posições orto (2 e 6). O emparelhamento é a acumulação de carga sobre eles "-". Além disso "densidade turno – o seu movimento a partir dos átomos nas posições meta-(3 e 5) de carbono na posição para (4). fórmula do estudo fenol por conveniência e acoplamento mútuo geralmente compreende a numeração dos átomos do anel de benzeno.
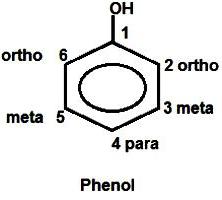
Propriedades químicas explicação fenol com base na sua estrutura electrónica
Processos conjugação do anel aromático e hidroxilo afectar as propriedades de ambas as partículas e todas as substâncias. Por exemplo, uma elevada densidade de electrões no átomo no posições orto e para (2, 4, 6) faz com que a ligação C-H de um ciclo aromático fenol mais reactivo. carga negativa reduzida dos átomos de carbono em posições meta (3 e 5). Ataque de partículas de electrófilos em reacções químicas exposta carbono no posições orto e para. A reacção de bromação de mudanças de benzeno ocorrer sob aquecimento forte e na presença de um catalisador. monogalogenoproizvodnoe formado – bromobenzeno. Fórmula fenol permite substância para reagir com bromo substancialmente instantaneamente sem aquecimento da mistura.
anel aromático afecta o grupo hidroxi ligação polaridade, aumentando-a. Hidrogénio se torna mais flexível, em comparação com álcoois saturados. Fenol reage com álcalis, formando sais – fenatos. Etanol não reage com álcalis, ou melhor, os produtos de reacção – etanolatos – decompor. Em termos químicos fenóis – ácido mais forte do que os álcoois.
Representantes de classe álcoois aromáticos
Molecular fenol fórmula homólogo – cresol (hidroxitolueno metilfenol) – C 7 H 8 O. Substância em matérias-primas naturais, muitas vezes acompanha fenol, também possui propriedades anti-sépticas. Outros homólogos de fenol:
- Catecol (1,2-hidroxibenzeno). fórmula química – C 6 H 4 (OH) 2.
- Resorcinol (1,3-di-hidroxibenzeno) – C 6 H 4 (OH) 2.
- Pirogalol (1,2,3-tri-hidroxibenzeno) – C 6 H 3 (OH) 3.
- Naphthol. Substância Fórmula molecular – C 10 H 7 OH. Ele é utilizado na fabricação de corantes, medicamentos, compostos aromáticos.
- Timol (2-isopropil-5-metilfenol). fórmula química – C 6 H 3 CH 3 (OH) (C 3 H 7). Usado em química orgânica sintética, e medicina.
- Vanilina excepto radical fenólico contém um grupo éter e um resíduo de aldeído. composto com a fórmula molecular – C 8 H 8 O 3. Vanilina é amplamente usado como um aromatizante artificial.
Fórmula reagente para a detecção de fenóis
determinação qualitativa de fenol pode ser realizada utilizando bromo. Como resultado da reacção de substituição de um precipitado branco tribromofenol. Catecol (1,2-hidroxibenzeno) é colorido na cor verde na presença de cloreto férrico dissolvido. Com o mesmo reagente reage fenol e um trifenol é formado com uma cor violeta. reacção qualitativa de resorcinol – aparecimento de cor violeta escuro, na presença de cloreto férrico. Gradualmente, a cor da solução fica preta. A fórmula do reagente, o qual é utilizado para reconhecer certos fenol e seus homólogos, – FeCl3 (cloreto férrico (III)).
Hidroxibenzeno, naftol, timol – todos os fenóis. A fórmula geral da substância para determinar a associação destes compostos para a série aromático. Todos os compostos orgânicos contendo na sua fórmula radical fenilo C 6 H 5, com os quais os grupos hidroxilo estão ligados directamente aos exibem propriedades especiais. Eles diferem de álcool é melhor expressa natureza ácida. Em comparação com as substâncias homóloga série benzeno, fenóis – composto químico mais activo.