fontes de corrente , química (HIT abreviado) – adaptação, em que a energia de uma reacção redox é convertida em energia eléctrica. Seus outros nomes – um eletroquímico celulares, célula galvânica , uma célula eletroquímica. O seu princípio de funcionamento é o seguinte: a interacção dos dois reagentes origina uma reacção química com uma alocação de potência de corrente eléctrica constante. Em outro processo actual fonte geradora de electricidade ocorre regime de vários estágios. Primeiro libertada energia térmica, em seguida, é transformado em mecânico e só depois em energia eléctrica. Vantagem HIT – processo de uma só fase, isto é, a energia eléctrica é obtida directamente, evitando os passos de proporcionar térmicas e energias mecânicas.

história
Como surgiu a primeira fonte de corrente? fontes químicas foram chamados de células galvânicas após o cientista italiano do século XVIII – Luigi Galvani. Ele era médico, anatomista, fisiologista e físico. Uma das áreas de sua pesquisa foi estudar as reações dos animais a várias influências externas. O método químico de produção de electricidade foi aberto Galvani acidentalmente, durante uma de suas experiências com rãs. Ele é ligado a um nervo exposto nas pernas de rã duas placas de metal. Quando isso aconteceu contração muscular. explicação própria deste fenômeno da Galvani estava errado. Mas os resultados de seus experimentos e observações ajudou seu compatriota Alessandro Volta em estudos posteriores.
Volta expôs no seu trabalho a teoria de ocorrência de corrente eléctrica através de uma reacção química entre os dois metais em contacto com o tecido muscular da rã. A primeira fonte de corrente químico parecia ser um recipiente com solução salina, com placas imersas nela de zinco e de cobre.
Na escala industrial CCS começou a ser produzido na segunda metade do século XIX, graças ao francês Leklanshe que inventaram as células de manganês-zinco primário com eletrólito de sal, em homenagem a ele. Depois de alguns anos, esta foi melhorada célula eletroquímica a outros cientistas e é a única fontes químicas primárias de energia elétrica antes de 1940.
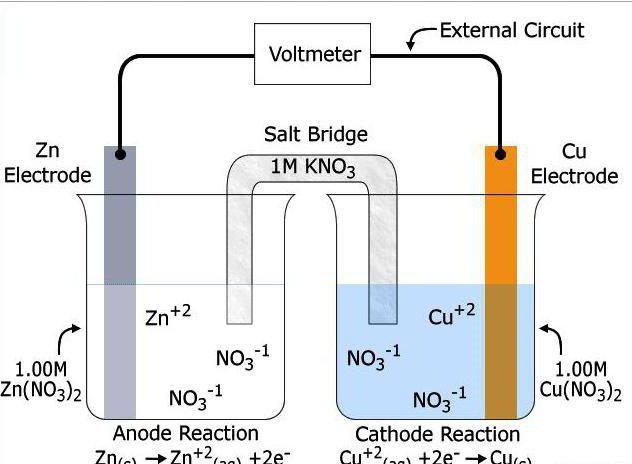
Desenho e operação HIT
dispositivo de fonte de corrente química inclui dois eléctrodos (condutores do primeiro tipo) e o electrólito interveniente (condutor do segundo tipo, ou condutor de iões). Na fronteira do potencial eletrônico surge entre eles. O eléctrodo no qual o agente de redução é oxidado chamado o ânodo, e a uma recuperação no qual o oxidante – cátodo. Juntamente com o eletrólito, eles constituem um sistema eletroquímico.
Um produto secundário da reacção redox entre os eléctrodos é a ocorrência de uma corrente eléctrica. Durante esta reacção, o agente de redução é oxidado e o oxidante dá os electrões que os aceitam e devido a isso é restaurado. A presença do electrólito entre o cátodo e o ânodo é um pré-requisito da reacção. Se apenas misture pós de dois metais diferentes, sem descarga elétrica não ocorre, toda a energia será liberada como calor. O electrólito é necessário para simplificar o processo de transferência de electrões. Na maioria das vezes atua solução salina ou fusão de sua qualidade.
Os eletrodos parecido com placa de metal ou grade. Na sua imersão no electrólito surge uma diferença de potencial eléctrico entre eles – a tensão do circuito aberto. O ânodo tem a tendência de impacto de elétrons e um cátodo – a sua adopção. Na sua superfície de reacção química é iniciada. Pararam pela abertura da cadeia, bem como quando um dos reagentes consumido. Quebra tem lugar por remoção de um dos eléctrodos ou de electrólito.

sistemas composição eletroquímicos
fontes de corrente oxidantes químicos são utilizados como sais de ácidos com oxigénio, o oxigénio, halogenetos, idos de metal mais elevadas composto nitroorganic e t. D. agentes aí são os metais e os seus óxidos inferiores, hidrogénio, compostos de hidrocarbonetos e redução. Como electrólitos utilizados:
- As soluções aquosas de ácidos, álcalis, sal e assim por diante. D.
- As soluções não aquosas com condutividade iónica obtidos por dissolução do sal em solventes orgânicos ou inorgânicos.
- sal derrete.
- compostos sólidos com estrutura iónica, em que um dos iões móveis.
- eletrólitos matriz. Estas soluções líquidas ou fundidos estão localizados nos poros de um corpo sólido não-condutor – elektronositelya.
- eletrólitos Ion Exchange. Esta conexão sólida com os grupos iônicos fixos do mesmo sinal. outro sinal de Jonas, enquanto móvel. Esta propriedade faz com que a condutividade da unipolar eletrólito.

bateria galvânica
fontes de corrente químicos consistem em células eletroquímicas – células. A tensão em uma destas células é pequena – de 0,5 a 4V. Dependendo das necessidades, HIT usar a bateria galvânica, que consiste de vários elementos ligados em série. Às vezes é usado em paralelo ou em conexão em série-paralelo de vários elementos. Num circuito em série sempre incluir apenas as mesmas pilhas ou baterias. Eles devem ter os mesmos parâmetros são: sistema eletroquímico, design, variação e tamanho do processo. Para a ligação em paralelo é possível a utilização de elementos de tamanhos diferentes.

HIT classificação
fontes químicas diferem em:
- tamanho;
- construção;
- reagentes;
- Natureza reação energoobrazuyuschey.
Estes parâmetros definem o desempenho do CCS adequados para uma aplicação particular.
Classificação de células eletroquímicas com base em diferenças de princípio de funcionamento. Dependendo dessas características, distinguem:
- fontes químicas primárias – itens descartáveis. Eles têm certos reagentes banco, que é consumida na reacção. Depois de tal célula de descarga de cheia perde eficiência. Em outro HIT primário é chamado de células galvânicas. Fiel simplesmente chamá-los – o elemento. O exemplo mais simples de uma fonte de energia primária – "Bateria" AA.
- fontes recarregáveis químicos atuais – baterias (também chamado de secundário, HIT reversível) são elementos reutilizáveis. Por passagem de uma corrente a partir do circuito externo na direcção inversa através da bateria após descarga gasto reagentes completos são regenerados de novo acumulador de energia química (a ser carregada). Devido à possibilidade de cobrar a partir de um dispositivo de fonte de corrente constante externo é usado por um longo tempo, intermitentemente para recarregar. O processo de geração de energia eléctrica é chamado a descarga do acumulador. Estes incluem baterias de acerto de muitos dispositivos eletrônicos (laptops, telefones celulares e assim por diante. N.).
- fontes químicas térmicas – Dispositivos de ação contínua. Durante o seu funcionamento, há um fluxo contínuo de novos lotes de reagentes e remoção de produtos de reacção.
- As células (polutoplivnyh) combinados electroquímicos tem um estoque de um dos reagentes. O segundo aparelho é alimentado para o exterior. A vida útil do dispositivo depende do fornecimento do primeiro reagente. fontes químicas combinados de corrente elétrica são usados como baterias, se houver a possibilidade de restaurar sua carga passando a corrente a partir de uma fonte externa.
- HIT renovável recarregada mecânica ou quimicamente. Para eles, é possível substituir após uma carga completa passou reagentes sobre novas porções. Ou seja, eles não são dispositivos contínuas também, como as baterias periodicamente recarregada.

características HIT
As principais características das fontes de energia químicas incluem:
- tensão de circuito aberto (OCV ou uma tensão de descarregamento). Esta taxa depende principalmente do sistema electroquímico (combinação de um agente redutor, o agente oxidante e o electrólito). Também OCV afectar a concentração de electrólito, grau de descarga, temperatura e outros. OCV depende do valor da corrente que flui através do HIT.
- Poder.
- A corrente de descarga – dependendo da resistência do circuito externo.
- Capacidade – a quantidade máxima de energia que dá HIT quando está totalmente descarregada.
- O conteúdo de energia – energia máxima recebida no dispositivo de descarga completa.
- características energéticas. No caso das baterias, é garantido principalmente número de ciclos de carga-descarga, sem reduzir a capacidade de voltagem ou carga (de recursos).
- desempenho gama de temperaturas.
- tempo de armazenamento – a quantidade máxima de tempo entre a fabricação e o primeiro dispositivo de descarga.
- vida de serviço – o armazenamento total máximo e vida profissional. Para pilhas de combustível são períodos importantes de serviço com operação contínua e intermitente.
- A energia total fornecida para toda a vida útil.
- resistência mecânica em relação à vibração, choque, e assim por diante. N.
- Capacidade de trabalhar em qualquer posição.
- Confiabilidade.
- Fácil manutenção.
Requisitos para HIT
O design de células eletroquímicas deve fornecer um ambiente propício para a reação mais eficiente. Estas condições incluem:
- prevenção de fugas de corrente;
- trabalho uniforme;
- resistência mecânica (incluindo selagem);
- separação dos reagentes;
- um bom contacto entre os eléctrodos e electrólitos;
- a corrente de descarga a partir da zona de reacção para uma saída externa com perdas mínimas.
Fontes químicos de corrente deve atender aos seguintes requisitos gerais:
- os mais altos valores de parâmetros específicos;
- gama de temperatura máxima de operacionalidade;
- o maior stress;
- o custo mínimo de uma unidade de energia;
- Estabilidade da Tensão;
- cobrar preservação;
- segurança;
- facilidade de manutenção e, idealmente, não há necessidade para isso;
- longa vida útil.
HIT operação
A principal vantagem de pilhas – sem necessidade de qualquer tipo de manutenção. Antes de começar a usá-los o suficiente para verificar o aparecimento, prazo de validade. Quando ligado, é importante observar a polaridade e verificar a integridade dos contactos do dispositivo. Mais fontes químicas complexas – baterias, estão exigindo um cuidado mais sério. O propósito do seu serviço – a extensão máxima da vida. Cuidados com a bateria é:
- manutenção da limpeza;
- monitorar a tensão de circuito aberto;
- manter o nível de electrólito (para recarga apenas água destilada pode ser utilizado);
- O controlo da concentração de electrólitos (por meio de densímetro – dispositivo simples para medir a densidade do fluido).
Durante a operação de células eletroquímicas precisa cumprir todas as exigências relativas ao uso seguro de aparelhos elétricos.
HIT Classificação dos sistemas eletroquímicos
Tipos de fontes de corrente químicos, dependendo do sistema:
- levar (ácido);
- níquel-cádmio, níquel-ferro, níquel-zinco;
- manganês-zinco, de cobre-zinco, mercúrio, zinco, zinco-cloreto;
- prata-zinco, prata e cádmio;
- ar-metálico;
- níquel-prata-hidrogénio e hidrogénio;
- manganês e de magnésio;
- de lítio e t. d.
O uso moderno da HIT
Fontes químicos de corrente Atualmente é usado em:
- veículos;
- dispositivos portáteis;
- militar e tecnologia espacial;
- equipamento científico;
- Medicine (pacemakers).
Exemplos familiares de HIT em casa:
- pilhas (células secas);
- baterias eletrodomésticos portáteis e eletrônicos;
- fonte de alimentação ininterrupta;
- baterias de carro.
Especialmente amplamente adoptada fontes químicas de lítio de electricidade. Isto é devido ao facto de lítio (Li) tem a maior densidade de energia. O fato de que ele possui o negativo potencial do eléctrodo de todos os outros metais. baterias de lítio (LIA) à frente de todos os outros valores de CCS e energia específica da tensão de funcionamento. Agora eles gradualmente dominar uma nova esfera – transporte rodoviário. No futuro, os desenvolvimentos científicos relacionados com a melhoria de baterias de lítio, irá se mover na direção de modelos ultrafinos e baterias pesadas grandes.














