Este material não apenas informa como as partículas estão dispostas em sólidos, mas também como se movem em gases ou em líquidos. Os tipos de redes de cristal em várias substâncias também serão descritos.
Estado agregado
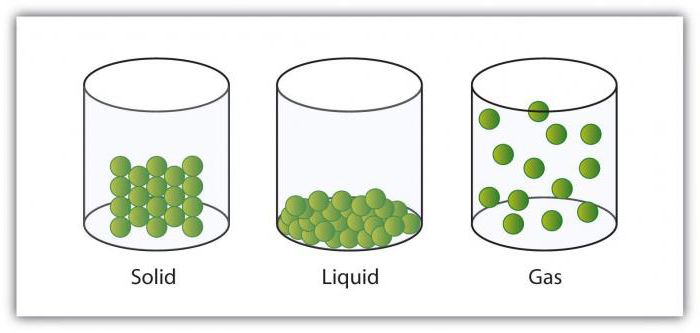
Existem certos padrões que indicam a presença de três estados agregados típicos, a saber: sólido, líquido e gás.
Defina os componentes para cada estado agregado.
- Os sólidos são praticamente estáveis em volume e forma. A última mudança é extremamente problemática sem custos adicionais de energia.
- O líquido pode facilmente mudar de forma, mas ainda mantém seu volume.
- As substâncias gasosas não mantêm a forma ou o volume.
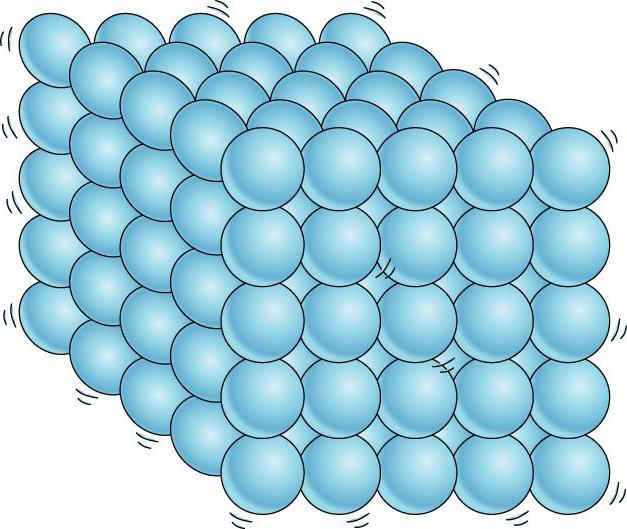
O principal critério pelo qual o estado agregado é determinado é a localização das moléculas e as formas de seu movimento. Em uma substância gasosa, a distância mínima entre moléculas individuais é muito maior que elas mesmas. Por sua vez, as moléculas de substâncias líquidas não se dispersam em longas distâncias nas condições usuais para elas e mantêm seu volume. As partículas ativas em sólidos são dispostas em uma ordem estritamente definida, cada uma delas, como um relógio de pêndulo, move-se sobre um certo ponto na rede cristalina. Isso dá aos sólidos força e rigidez especiais.
Portanto, neste caso, a questão mais relevante é como as partículas ativas estão localizadas em sólidos. Em todos os outros casos, os átomos (moléculas) não possuem uma estrutura tão ordenada.
Recursos de fluido
É necessário prestar especial atenção ao fato de que os líquidos são um tipo de ligação intermediária entre o estado sólido do corpo e sua fase gasosa. Assim, à medida que a temperatura baixa, o líquido se solidifica e, quando ele aumenta acima do ponto de ebulição da substância, passa para um estado gasoso. No entanto, o líquido tem características comuns com substâncias sólidas e gasosas. Assim, em 1860, o destacado cientista doméstico DI Mendeleyev estabeleceu a existência da chamada temperatura crítica – fervura absoluta. Este é um valor no qual o limite fino entre o gás e a matéria no estado sólido desaparece.
O próximo critério, que combina dois estados agregados vizinhos, é a isotropia. Nesse caso, suas propriedades são as mesmas em todas as direções. Os cristais, por sua vez, são anisotrópicos. Como os gases, os líquidos não têm uma forma fixa e ocupam todo o volume da embarcação em que estão localizados. Ou seja, eles têm baixa viscosidade e alta fluidez. Diante uns dos outros, as micropartículas líquidas ou de gás fazem movimentos livres. Costumava ser que no volume ocupado pelo líquido não há movimento molecular ordenado. Assim, líquido e gás se opuseram aos cristais. Mas como resultado de estudos subseqüentes, a similaridade entre os corpos sólido e líquido foi comprovada.
Na fase líquida a uma temperatura próxima da solidificação, o movimento térmico se assemelha ao movimento em sólidos. Neste caso, o líquido ainda pode ter uma certa estrutura. Portanto, quando respondemos a questão de como as partículas são dispostas em sólidos em líquidos e gases, podemos dizer que, no último, o movimento das moléculas é caótico, desordenado. Mas, em moléculas de sólidos, ocupam na maioria dos casos uma posição definida e fixa.
O fluido é um tipo de intermediário. E quanto mais a temperatura estiver fervendo, mais moléculas se movem como nos gases. Se a temperatura estiver mais próxima da transição para a fase sólida, as micropartículas começam a se mover cada vez mais de forma ordenada.

Mudança no estado das substâncias
Considere o exemplo mais simples de uma mudança no estado da água. O gelo é uma fase sólida de água. Sua temperatura está abaixo de zero. A uma temperatura de zero, o gelo começa a derreter e se transforma em água. Isso é explicado pela destruição da rede cristalina: quando aquecida, as partículas começam a se mover. A temperatura a que a substância altera o estado agregado é denominada ponto de fusão (no nosso caso é 0 para água). Observe que a temperatura do gelo permanecerá em um nível até que funda completamente. Neste caso, os átomos ou moléculas do líquido mover-se-ão da mesma maneira que nos sólidos.
Depois disso, continuaremos a aquecer a água. As partículas começam a se mover de forma mais intensa até que nossa substância chegue ao próximo ponto da mudança no estado agregado – o ponto de ebulição. Esse momento ocorre quando os laços entre as moléculas que o formam são interrompidos devido à aceleração do movimento – então ele adquire um caráter livre e o líquido em consideração passa para a fase gasosa. O processo de transformação de uma substância (água) de uma fase líquida para uma gasosa é chamado de fervura.
A temperatura a que a água ferve é chamada de ponto de ebulição. No nosso caso, esse valor é igual a 100 graus Celsius (a temperatura depende da pressão, a pressão normal é de uma atmosfera). Nota: até o líquido existente completamente e completamente se transformar em vapor, a temperatura permanece constante.
Também é possível reverter o processo de transferência de água do estado gasoso (vapor) para um líquido, que é chamado de condensação.
Então você pode observar o processo de congelamento – o processo de transição de um líquido (água) para uma forma sólida (o estado inicial é descrito acima é gelo). Os processos descritos acima permitem obter uma resposta direta à forma como as partículas estão dispostas em sólidos, líquidos e gases. A localização e o estado das moléculas de uma substância dependem do seu estado agregado.
O que é um corpo sólido? Como as micropartículas se comportam nela?
Um corpo sólido é um estado de meio material, cuja característica distintiva é a preservação da forma constante e a natureza constante do movimento térmico das micropartículas, que realizam flutuações insignificantes. Os corpos podem estar em estado sólido, líquido e gasoso. Há também o quarto estado, que os cientistas modernos tendem a atribuir ao número de agregados – este é o chamado plasma.
Assim, no primeiro caso, qualquer substância, como regra, tem uma forma constante e inalterada, e isso tem um efeito chave sobre como as partículas estão dispostas em sólidos. A nível microscópico, pode-se observar que os átomos que compõem um sólido são conectados uns aos outros por ligações químicas e estão localizados nos nós da rede cristalina.
Mas há uma exceção – substâncias amorfas que estão em estado sólido, mas a presença de uma rede de cristal não pode se vangloriar. É por isso que podemos responder a questão de como as partículas estão dispostas em sólidos. A física no primeiro caso indica que os átomos ou moléculas estão nos locais da rede. Mas, no segundo caso, certamente não há tal ordenação, e essa substância é mais como um líquido.
Física e a estrutura possível de um sólido
Neste caso, a substância tende a manter o seu volume e, claro, a forma. Ou seja, para mudar o último, é necessário fazer esforços, e não importa se é um objeto metálico, um pedaço de plástico ou de plastilina. A razão está em sua estrutura molecular. E mais precisamente, na interação de moléculas, das quais o corpo consiste. Neste caso, eles estão mais próximos. Esse arranjo de moléculas é de natureza recorrente. É por isso que as forças de atração mútua entre cada um desses componentes são muito grandes.
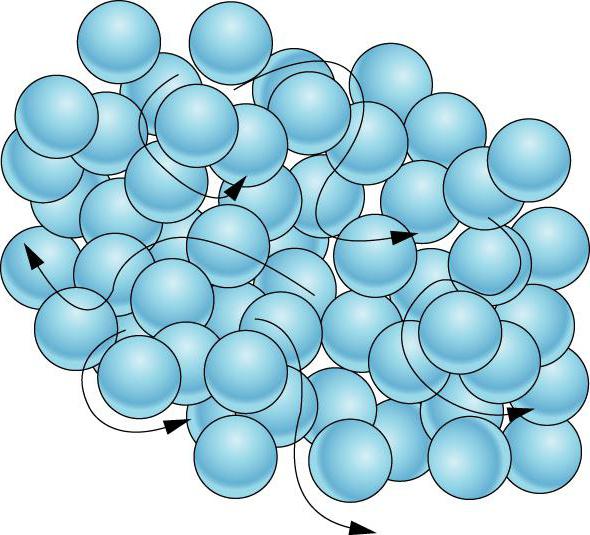
A interação das micropartículas explica a natureza de seus movimentos. A forma ou o volume de um corpo tão sólido é difícil de corrigir em uma direção ou outra. As partículas de um corpo sólido são incapazes de se mover aleatoriamente em todo o volume de um sólido, mas podem apenas oscilar perto de um certo ponto no espaço. As moléculas do sólido flutuam caóticamente em diferentes direções, mas se deparam com semelhantes, o que os remete para seu estado original. É por isso que as partículas em sólidos estão localizadas, como uma regra, em uma ordem estritamente definida.
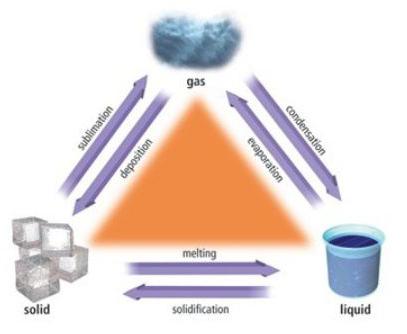
Partículas e sua localização em um sólido
Os corpos sólidos podem ser de três tipos: cristalino, amorfo e compósitos. É a composição química que afeta o arranjo de partículas em sólidos.
Os sólidos cristalinos têm uma estrutura ordenada. Suas moléculas ou átomos formam uma rede espacial cristalina de forma regular. Assim, um corpo sólido em um estado cristalino tem uma rede cristalina definitiva, que por sua vez define certas propriedades físicas. Esta é a resposta para a forma como as partículas estão dispostas em um sólido.
Deixe-nos dar um exemplo: há muitos anos em São Petersburgo, um estoque de botões de lata brilhantes brancos foi armazenado no armazém, que, quando a temperatura baixou, perdeu seu brilho e passou de branco para cinza. Os botões estavam espalhados em um pó cinza. "Praga de lata" – a chamada "doença", mas na verdade foi uma reestruturação da estrutura de cristal sob a influência de baixa temperatura. Estanho durante a transição da variedade branca para os esmagamentos cinza em pó. Os cristais, por sua vez, são divididos em mono- e policristalinas.
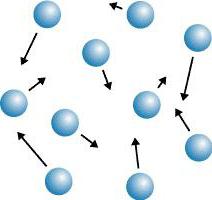
Cristais simples e policristalinas
Monocristais (sal de mesa) são cristais homogêneos únicos representados por uma rede cristalina contínua sob a forma de polígonos regulares. Os policristalinos (areia, açúcar, metais, pedras) são corpos cristalinos que cresceram a partir de pequenos cristais dispostos caótica. Em cristais, observa-se um fenômeno como a anisotropia.
Amorfo: um caso especial
Os corpos amorfos (resina, colofónia, vidro, âmbar) não têm uma ordem estrita e rigorosa no arranjo das partículas. Este é um caso não padrão da ordem em que as partículas estão em sólidos. Neste caso, o fenômeno da isotropia é observado, as propriedades físicas dos corpos amorfos são as mesmas em todas as direções. Em altas temperaturas, tornam-se similares aos líquidos viscosos, e a baixas temperaturas são semelhantes aos sólidos. Quando expostos a efeitos externos, eles exibem simultaneamente propriedades elásticas, ou seja, se separam em partículas em miniatura, como corpos sólidos e fluidez: começam a fluir como líquidos sob efeitos prolongados de temperatura. Eles não possuem temperaturas definidas de fusão e cristalização. Quando aquecidos, os corpos amorfos suavizam.
Exemplos de substâncias amorfas
Pegue, por exemplo, açúcar comum e descubra o arranjo de partículas em sólidos em vários casos em seu exemplo. Neste caso, o mesmo material pode ocorrer de forma cristalina ou amorfa. Se o açúcar derretido congelar lentamente, as moléculas formam filas iguais – cristais (açúcares ou açúcar granulado). Se o açúcar derretido, por exemplo, despeje em água fria, o resfriamento ocorrerá muito rapidamente e as partículas não têm tempo para formar as linhas corretas – a massa fundida irá endurecer sem formar cristais. Então, resulta açúcar doce (isto é açúcar não cristalino).
Mas, depois de algum tempo, essa substância pode recristalizar, as partículas são coletadas nas fileiras da direita. Se o doce de açúcar se deitar por vários meses, ele começará a ficar coberto com uma camada solta. Então, apareça na superfície dos cristais. Para o açúcar, o período será de vários meses, e para a pedra – milhões de anos. Um exemplo único é o carbono. O grafite é um carbono cristalino, sua estrutura é em camadas. Um diamante é o mineral mais difícil da terra, capaz de cortar vidro e serrar pedras, é usado para perfurar e polir. Neste caso, a substância é um carbono, mas a característica é a capacidade de formar diferentes formas cristalinas. Esta é outra resposta para como as partículas são dispostas em um sólido.
Resultados. Conclusão
A estrutura e disposição das partículas nos sólidos depende do tipo de substância à qual a substância pertence. Se a substância for cristalina, a disposição das micropartículas será ordenada. As estruturas amorfas não possuem essa característica. Mas os compósitos podem pertencer ao primeiro e ao segundo grupo.
Em um caso, o líquido se comporta de forma semelhante a um sólido (a uma temperatura baixa que é próxima da temperatura de cristalização), mas também pode atuar como um gás (à medida que ele se eleva). Portanto, neste material de revisão, examinamos como as partículas estão localizadas não apenas em sólidos, mas também em outros estados agregados básicos de matéria.