Um complexo proteico, excepto o componente proteico compreende-se um grupo adicional de uma natureza diferente (prótese). Como este componente são os hidratos de carbono, lípidos, metais, resuos de fosfórico , ácido nucleico. Qual é a diferença proteínas simples de complexo, sobre o que tipos de divididos estas substâncias, e quais são suas características, este artigo irá dizer. A principal diferença entre as substâncias em questão – sua composição.
proteínas complexas: Definição
Este material de dois componentes, que incluem a proteína simples (cadeias peptídicas) e material não proteico (grupo prostético). No processo de hidrólise os aminoácidos são formadas, e a porção não-proteína de produtos de decomposição. Qual é a diferença proteínas simples de complexo? O primeiro consiste apenas de aminoácidos.
A classificação e caracterização de proteínas complexas
Estas substâncias são divididos em tipos, dependendo do tipo de grupos adicionais. Para proteínas complexas incluem:
- Glicoproteínas – proteínas, moléculas de que contêm uma porção de hidrato de carbono. Entre eles estão os proteoglicanos (componentes espaço intercelular), incluindo na sua estrutura mucopolissacarídeos. Para imunoglobulinas são glicoproteínas.
- Lipoproteínas compreender um componente de lido. Estes incluem apolipoproteínas, desempenhando a função de garantir o transporte de lípidos.
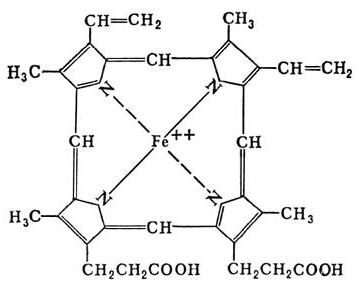
- Metaloproteínas conter iões metálicos (cobre, manganês, ferro, etc.), ligado através de uma interacção dador-aceitador. Este grupo não incluem proteínas heme compreendendo o composto profirinovogo anel com ferro, e outros semelhantes na estrutura do composto (clorofila, em particular).
- Nucleoproteínas – proteas com ligações não-covalentes com ácidos nucleicos (ADN, ARN). Estes incluem cromatina – o componente de cromossomos.
- 5. Fosfoproteidy, que incluem caseína (coalhada de proteína complexo) incluir resíduos ligados covalentemente de ácido fosfórico.
- Chromoproteins coloração une o componente protético. Esta classe inclui proteínas heme, clorofilas e flavoproteínas.
Características de glicoproteínas e proteoglicanos
Estas proteínas são substâncias complexas. Os proteoglicanos conter uma grande fracção de hidratos de carbono (80-85%), o conteúdo de glicoproteína convencional é de 15-20%. ácidos urónicos só estão presentes na molécula os proteoglicanos, os hidratos de carbono diferem nas suas unidades de repetição de estrutura regulares. Qual é a estrutura e função das proteínas complexas, glicoproteínas? Suas cadeias de carboidratos incluem apenas 15 unidades e tem uma estrutura irregular. As estruturas de hidratos de carbono de glicoproteínas comunicação com o componente proteico é, tipicamente através de resíduos de aminoácidos tais como resíduos de serina ou asparagina.

As funções de glicoproteínas:
- Fazem parte da parede da célula bacteriana, osso tecido conjuntivo e da cartilagem, o colagénio envolver as fibras de elastina.
- Desempenhar um papel protetor. Por exemplo, esta estrutura tem anticorpos, interferões, factores de coagulação do sangue (protrombina, fibrinogénio).
- São receptores que interagem com o efector – uma molécula não-proteína pequenos. Última, juntando-se a proteína, conduz a uma mudança na sua conformação, o que leva a uma resposta intracelular específico.
- Executar a função hormonal. Ele refere-se a uma glicoproteína de gonadotropina, hormona estimulante da tiróide e adrenocorticotrópica.
- Substância transportada no sangue e iões através da membrana celular (transferrina, transcortina, albumina, Na +, K + -ATPase).
Por glicoproteína incluem enzimas colinesterase e nuclease.
Mais sobre proteoglicanos
Tipicamente proteína complexo proteoglicano inclui na sua grande cadeia de hidrato de carbono com estrutura de resíduos repetidos de dissacárido consistindo em um ácido urónico e açúcar aminado. Oligo ou polissacarídeos cadeias chamado glicanos. O primeiro contêm usualmente 2-10 unidades monoméricas.
Dependendo da estrutura das cadeias de açúcar secretam seus tipos diferentes, por exemplo, heteropolissacarídeos ácidos com mais grupos ácidos ou glicosaminoglicano que contêm grupos amino. Estas últimas incluem:
- O ácido hialurónico, que é utilizado activamente em cosméticos.
- A heparina, que impede a coagulação do sangue.
- sulfato de queratano – componentes de cartilagem e córnea.
- sulfatos de condroitina são parte da cartilagem e fluido sinovial.
Estes polímeros – componentes proteoglicano que preenchem o espaço intercelular, retêm água, lubrificar as partes móveis das articulações, que são os seus componentes estruturais. A hidrofilicidade (boa solubilidade em água) proteoglicanos permite-los no espaço intercelular para criar uma barreira para as moléculas grandes e microorganismos. Com a sua ajuda criar uma matriz em gel em que as fibras submersas de outras proteas importantes, tais como o colagénio. Suas bandas no ambiente de proteoglicanos tem uma forma de árvore.
Características e tipos de lipoproteínas
Lipoproteína de proteína complexo tem um carácter hidrófilo e hidrófobo dupla bem pronunciado. A molécula de núcleo (parte hidrofóbica) formar uma ésteres não-polares de colesterol e triacilglicidos.
Do lado de fora na zona hidrófila disposta parte de proteínas, fosfolípidos, colesterol. Existem diversas variedades de proteínas lipoproteínas, dependendo de sua estrutura.
As principais classes de lipoproteínas:
- Sofisticado proteína de alta densidade (HDL, α-lipoproteína). Move o colesterol para o fígado e os tecidos periféricos.
- De baixa densidade (LDL, p-lipoproteínas). Além de colesterol é transportado triacilglicerídeos e fosfolipídios.
- Muito baixa densidade (VLDL, pré-β-lipoproteína). Executar uma função semelhante à LDL.
- Os quilomicrons (CM). Transporta os ácidos graxos e colesterol a partir do intestino após a ingestão de alimentos.
patologia vascular, tal como arteriosclerose, resulta da relação imprópria de diferentes tipos de lipoproteínas no sangue. Por caracterização da composição podem ser revelados vários mudança estrutura tendências fosfolidos (de HDL para quilomicron): reduzindo a proporção de proteína (80-10%), e fosfolípidos, triacilglicidos aumento percentual (20 a 90%).
Entre as muitas enzimas importantes, metaloproteínas
Metaloproteínas pode incluir vários iões metálicos. A sua presença afecta a orientação do substrato no sítio activo (catalítico) da enzima. íons metálicos estão localizados no sítio ativo e desempenham um papel importante na reação catalítica. ião frequentemente actua como um aceitador de electrões.
Exemplos de metais contidos na estrutura de metaloproteínas enzima:
- O cobre é incluído no citocromo-oxidase, o qual, juntamente com heme contém um ião de metal. A enzima envolvida na formação de ATP na cadeia respiratória.
- Ferro contêm enzimas tais como a ferritina, ferro desempenha a função de deposição de uma célula; transferrina – um transportador de ferro no sangue; reacção de catalase é responsável pela neutralização do peróxido de hidrogénio.
- Zinco – metal, que é característica para o álcool envolvido na oxidação de etanol e álcoois similares; desidrogenase de lactato – uma enzima no metabolismo do ácido láctico; anidrase carbónica, que catalisa a formação de ácido carbónico a partir de CO 2 e H 2 O; fosfatase alcalina, realiza a clivagem hidrolítica de ésteres de fosfato com vários compostos; α2-macroglobulina – proteína sangue antiproteazny.
- O selénio é uma parte tireoperoxidase participar na formação das hormonas da tiróide; glutationa peroxidase, agindo como uma função antioxidante.
- O cálcio é característica para a estrutura de α-amilase – enzima hidrolítica amido de clivagem.
fosfoproteína
Essa parte da fosfoproteína proteína complexa? Para esta categoria caracterizada pela presença do grupo fosfato, que está ligada à porção de proteína através de um aminoácido com um grupo hidroxilo (tirosina, serina ou treonina). O que faz de ácido fosfórico, enquanto que na estrutura de uma protea? Ele altera a estrutura molecular, dando-lhe uma carga, aumenta a solubilidade, afecta as propriedades da proteína. Exemplos são o leite caseína fosfoproteína e albumina de ovo, mas principalmente para a categoria de proteínas complexas são enzimas.
grupo fosfato desempenha um papel funcional importante, pois muitas proteínas associadas com ele não é permanente. Na gaiola todo o tempo, os processos de fosforilação e desfosforilação ocorrer. Como resultado, a regulação é realizada nas proteínas. Por exemplo, se as histonas – proteínas ligadas aos ácidos nucleicos prossegue no estado fosforilado, em seguida, a actividade do genoma (o material genético) aumenta. Por fosforilação depende da actividade de enzimas tais como a sintase de glicogio e fosforilase de glicogénio.
nucleoproteína
Nucleoproteínas – proteínas ligadas aos ácidos nucleicos. Eles são – uma parte integrante do armazenamento e regulação de material genético, o trabalho de ribossomas, desempenhando a função de síntese de proteínas. A forma mais simples da vida do vírus pode ser chamado de ribo- e dezoksiribonukleoproteinami, uma vez que elas consistem de material genético e proteínas.
À medida que a interacção de ácido desoxirribonucleico (ADN) e histona? Na cromatina isolada dois tipos de proteínas associadas com o ADN (histonas e não-histona). O primeiro passo envolvido no compactação inicial de ADN. molécula de ácido nucleico é torcido em torno das proteínas para formar nucleossomas. A estrutura do fio formado é semelhante ao das pérolas, são formados super-enrolado (cromatina fibrila) e superenrolamento (genonema interfase). Pela acção de proteínas de histonas e proteínas de níveis mais elevados que proporciona uma redução nas dimensões de ADN milhares de vezes. Basta comparar o tamanho do cromossoma e o comprimento do ácido nucleico, para avaliar a importância de proteínas (6-9 cm e 6.10 microns, respectivamente).
Quais são chromoproteins
Chromoproteins contêm muito diversos grupos que são unidos apenas por uma coisa – a presença da cor no componente protético. proteínas complexas nesta categoria são divididos em: (hemoproteinas conter estrutura heme) retinalproteiny (vitamina A), flavoproteínas (vitamina B2), kobamidproteiny (vitamina B12).
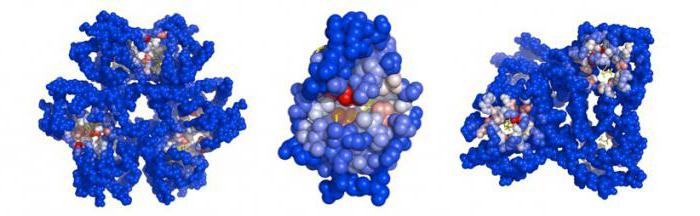
Hemoproteinas classificados de acordo com as funções de um não enzimática (hemoglobina mioglobinovy e proteína) e enzimas (citocromos, catalases, peroxidases).
Flavoproteínas conter como derivados de componentes protéticos de vitamina B2, flavina mononucleótido (FMN) ou dinucleótido de flavina adenina (FAD). Estas enzimas estão também envolvidos nas transformações redox. Estes incluem Oxirredutases.
O que é citocromos?
Como foi descrito acima, consiste de porfirina heme. A sua estrutura é composta por quatro anéis de pirrole e um ferro divalente. Um grupo especial de enzimas heme – citocromos, que diferem na composição de aminoácidos e o número de cadeias peptídicas, especializados para a realização da reacção redox, devido a que é fornecida por transferência de electrões na cadeia respiratória. Estas enzimas estão envolvidas na oxidação microssómica – as primeiras reacções de biotransformação xenobióticos, levando a sua depuração e metabolismo de muitas substâncias endógenas e exógenas, tais como esteróides, ácidos gordos saturados.
grupo prostético Efeito
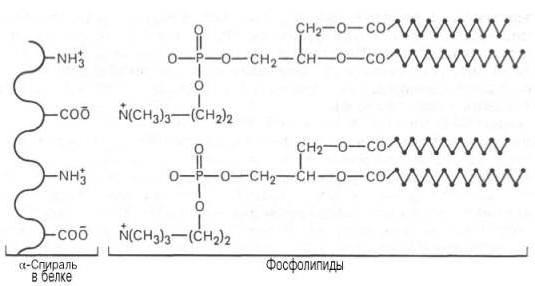
grupo prostético, que é uma parte do complexo de proteína afecta as suas propriedades: alterar a sua carga, solubilidade, termoplasticidade. Por exemplo, uma tal acção tem os resíduos de ácido fosfórico ou monossacáridos. A porção hidrato de carbono incluídos no complexo de proteína, protegê-lo da proteólise (destruídos por hidrólise) afecta a penetração de moléculas através da membrana celular, sua secreção e triagem. O agrupamento lipídico permite que a proteína para criar os canais para o transporte de compostos fracamente solúveis em água (hidrofóbicos).
A estrutura e função das proteínas complexas são totalmente dependentes do grupo prostético. Por exemplo, utilizando a heme-ferro contendo oxigénio na hemoglobina ligação ocorre e dióxido de carbono. Devido nucleoproteínas formados pela interacção das histonas, protaminas com ADN ou ARN ocorre proteger material genético, o seu armazenamento compacto, o processo de ligação de ARN na síntese de proteínas. Nucleoproteínas chamado complexos estáveis de proteínas e ácidos nucleicos.
conclusão
Assim, as proteínas complexas têm uma grande variedade de funções no corpo. Portanto, o consumo de macro e micronutrientes tão importante para a saúde. Os metais são parte de muitas enzimas. Conhecendo a bioquímica, especialmente a situação sanitária e ambiental de residência, você pode ajustar o modo de seu próprio poder. Por exemplo, o território isolado, caracterizado por deficiência de um elemento. Sua entrada adicional na dieta na forma de aditivos permite compensar a deficiência.















