Uma das definições de vida é a seguinte: "A vida é o modo de existência de corpos de proteína." No nosso planeta, sem excepção organismos contêm tais materiais orgânicos, tais como proteínas. Esse artigo vai descrever as proteínas simples e complexas diferenças na estrutura molecular identificados, e discute as suas funções na célula.
O que são proteínas
Do ponto de vista da bioquímica – polímeros orgânicos de elevado peso molecular, de monómeros que são 20 tipos diferentes de aminoácidos. Eles são ligados entre si por ligações químicas covalentes, péptido de outro modo conhecido. Uma vez que os monómeros de proteína são compostos anfotéricos, que contêm tanto um grupo amino e um grupo funcional carboxilo. ligação química CO-NH entre eles ocorre.
Se o polipéptido é composto de resíduos de aminoácido ligações, forma-se uma proteína simples. As moléculas do polímero, compreendendo ainda iões de metal, vitaminas, nucleidos, hidratos de carbono – são proteínas complexas. Em seguida, nós consideramos a estrutura espacial de polipeptídeos.
Os níveis de organização de moléculas de proteínas
Eles são apresentados em quatro configurações diferentes. A primeira estrutura – linear, que é o mais simples e tem a forma de uma cadeia de poliptido durante a sua espiral a formação de ligações de hidrogénio adicionais. Eles estabilizar a hélice, que é chamado de uma estrutura secundária. instituições de ensino superior têm proteínas simples e complexos, a maioria das células vegetais e animais. A configuração do último – quaternário surge na interacção de várias moléculas da estrutura nativa, coenzimas unidos, ou seja, tais proteínas têm estrutura complexa, operar em diversas funções corporais.
Uma variedade de proteínas simples
Este grupo não é numerosos polipéptidos. Suas moléculas consistem apenas de resíduos de aminoácidos. Para incluir proteínas, tais como histonas e globulinas. O primeiro representou na estrutura do núcleo, e são combinadas com as moléculas de ADN. O segundo grupo – globulinas – são os principais componentes do plasma sanguíneo. Tal proteína, tais como gama globulina, executa as funções de defesa imune e é um anticorpo. Estes compostos podem formar complexos, que contêm hidratos de carbono complexos e proteínas. Tais proteínas fibrilares simples, tais como o colagénio e a elastina, fazem parte do tecido conjuntivo, cartilagem, tendões, pele. A sua principal função – a construção e apoio.
proteína tubulina é um membro de microtúbulos, os quais são componentes de cílios e flagelos de organismos unicelulares, tais como os ciliados, Euglena, flagelados parasitárias. Esta mesma proteína é um membro de organismos multicelulares (espermatozóides flagelos, cílios óvulos, epitélio ciliado do intestino delgado).
albumina de proteína serve para armazenar uma função (por exemplo, uma proteína de ovos de galinha). No endosperma de sementes de cereais – centeio, arroz, trigo – moléculas de proteína acumular. Eles são chamados de inclusões celulares. Estas substâncias são usadas no embrião da semente no início do seu desenvolvimento. Além disso, o alto teor de proteína do bicudo trigo é um indicador muito importante da qualidade da farinha. Pão cozido com farinha rica em glúten tem uma alta qualidade sabor e mais útil. Glúten conter chamado trigo duro. O plasma sanguíneo peixes de profundidade contém proteínas que previnem a morte do frio. Eles possuem também as propriedades anticongelantes, prevenir a morte do organismo, a temperaturas baixas de água. Por outro lado, na composição da parede celular de bactérias termófilas em fontes de energia geotérmica continha proteínas capazes de manter a sua configuração natural (estrutura terciária ou quaternária) e não desnaturar a temperaturas que variam de 50 a + 90 ° C.
proteid
Estes são proteínas complexas, que são caracterizadas por uma grande diversidade em conexão com as várias funções realizadas por eles. Como observado anteriormente, o grupo de polipeptídeos, excepto para a porção de proteína contém um grupo prostético. Sob a influência de vários factores, tais como temperatura elevada, os sais de metais pesados, concentrados de proteínas complexas alcalinos e ácidos podem alterar a sua forma espacial, simplificando-o. Este fenômeno é chamado de desnaturação. A estrutura das proteínas complexas é interrompido ligações de hidrogénio são quebrados, e as moléculas de perder as suas propriedades e funções. Como regra geral, a desnaturação é irreversível. Mas alguns dos polipéptidos de actuar como um catalisador, de condução e de funções de sinalização, é possível a renaturação – restaurando a estrutura natural dos proteids.

Se a ação é um fator de desestabilização indo por um longo tempo, a molécula de proteína é destruída completamente. Isto leva à ruptura de ligações peptídicas da estrutura primária. Restaurar proteína e sua função não é mais possível. Este fenômeno é chamado de destruição. Um exemplo é a cozedura de ovos: proteína líquido – albumina, localizado na estrutura terciária é completamente destruído.
biossíntese de proteínas
Mais uma vez, recordar que nos polipéptidos de organismos vivos é composto por 20 aminoácidos, algumas das quais são insubstituíveis. Este lisina, metionina, fenilalanina, e assim por diante. D. Eles entram na corrente sanguínea a partir do intestino delgado após dividi-la produtos proteicos. Para sintetizar os aminoácidos essenciais (alanina, prolina, serina), os fungos e os animais usam compostos contendo azoto. Plantas, sendo autotrófico, formar, independentemente, um necessários monómeros constituintes que representam proteínas complexas. Para esta reacções de assimilação eles são usados nitratos, amónia, ou isentos de azoto. Em alguns tipos de microrganismos fornecer-se com um conjunto completo de aminoácidos, enquanto que em outros apenas alguns são sintetizados monómeros. Estágios da biossíntese de proteínas ocorrem nas células de todos os organismos vivos. No núcleo da transcrio ocorre, e no citoplasma da célula – transmissão.
O primeiro passo – a síntese do precursor de ARNm ocorre pela polimerase de ARN da enzima. Ele rompe as ligações de hidrogênio entre as cadeias de DNA, e um deles no princípio da complementaridade recolhe molécula de pré-mRNA. É exposta a slaysingu que está madura, e, em seguida, sai do núcleo para o citoplasma, formando ácido ribonucleico mensageiro.
Para implementar a segunda etapa requer um organelos específicos – ribossomas e informação molecular e a transferência de ácidos ribonucleicos. Outra condição é importante a presença de ATP, como as reacções de metabolismo de plástico, que pertence à biossíntese de proteínas ocorre com absorção de energia.
Enzimas, a sua estrutura e função
Este é um grande grupo de proteínas (cerca de 2000), desempenhando o papel de substâncias que afectam a taxa de reacções bioquímicas nas células. Elas podem ser simples (trepsin, pepsina) ou complexo. proteínas complexa composta de apoenzima e coenzima. A especificidade da proteína em relação aos compostos para os quais actua, determina uma coenzima, e actividade proteids é observado apenas no caso em que o componente de protea ligado ao apoenzima. A actividade catalítica da enzima é independente da molécula, mas apenas pelo centro activo. A sua estrutura corresponde à estrutura química de substâncias catalisadas pelo princípio da "chave-fechadura", de modo que a acção de enzimas é estritamente específico. Funções de proteínas complexas estão em participação nos processos metabólicos e na sua utilização como aceitadores.
Classes de proteínas complexas
Eles foram desenvolvidos pelos bioquímicos, com base em critérios de 3: propriedades fisico-químicas, as características e as características estruturais proteids especificidade. O primeiro grupo inclui os polipéptidos de diferentes propriedades electroquímicas. Eles são divididos em básico, neutro e ácido. Em relação às proteínas de água pode ser hidrofílico, anfifílico e hidrofóbico. O segundo grupo de enzimas que têm sido considerados anteriormente. O terceiro grupo inclui polipéptidos que diferem na composição química grupo prostético (está chromoproteids, nucleoproteínas, metaloproteínas).
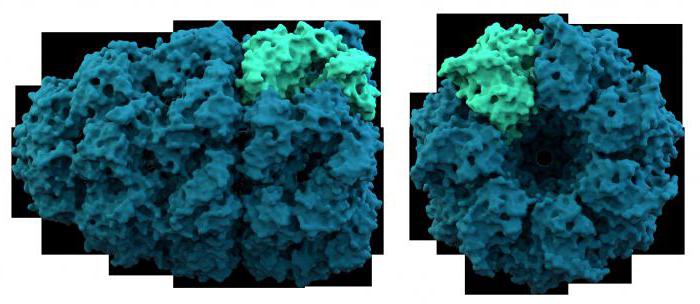
Considere as propriedades das proteínas complexas em mais detalhe. Assim, por exemplo, proteína ácida que é parte de ribossomas, contém 120 aminoácidos e é versátil. Ele está localizado nos organelos de síntese de proteínas, tanto em células procarióticas e eucarióticas. Um outro membro deste grupo – proteína S-100, é constituído por duas cadeias ligadas de iões de cálcio. Ele é membro de neurônios e glia – apoiar o tecido do sistema nervoso. A propriedade comum de toda a proteína ácida – um alto conteúdo de ácidos dicarboxílicos: glutâmico e aspártico. Por proteínas alcalinas incluem histonas – proteínas que compõem ARN e ADN ácidos nucleicos. A peculiaridade da composição química é a grande quantidade de lisina e arginina. As histonas, em conjunto com a forma cromossoma cromatina nuclear – estrutura celular hereditariedade crítico. Estas proteínas estão envolvidas nos processos de transcrição e tradução. proteínas anfifílicas amplamente representado nas membranas celulares, a formação de uma bicamada de lipoproteína. Assim, o grupo estudado as proteínas complexas acima discutidos, estávamos convencidos de que as suas propriedades físico-químicas devido à estrutura do componente proteico e grupos prostéticos.
Algumas proteínas de membrana celular complexos são capazes de reconhecer uma grande variedade de compostos químicos, tais como antigénios e reagir a eles. Esta sinalização proteids de função, que é muito importante para os processos de absorção selectiva, a partir de substâncias do ambiente externo, e para o proteger.
Glicoproteínas e proteoglicanos
Eles são proteínas complexas que diferem entre uma composição bioquímica grupos prostéticos. Se as ligações químicas entre o componente proteico e a parte de hidrato de carbono – covalentemente-glicósido, tais substâncias são chamadas glicoproteínas. Apoenzima eles apresentaram moléculas de mono e oligossacarideos, os exemplos de tais proteínas são protrombina, fibrinogénio (proteínas envolvidas na coagulação do sangue). Kortiko- e gonadotrópicas hormonas, interferões, enzimas e membrana são glicoproteínas. Em moléculas proteína parte de proteoglicanos é de apenas 5%, sendo o restante um grupo prostético (geteropolitsaharid). Ambas as peças são ligadas por uma ligação glicosídica dos grupos do grupo-treonina e arginina OH e NH-glutamina, e lisina. moléculas de proteoglicanos desempenhar um papel muito importante nas células do metabolismo de água-sal. Abaixo está uma tabela de proteínas complexas, estudamos.
| glicoproteínas | proteoglicanos |
| Componentes estruturais de grupos prostéticos | |
| 1. monossacidos (glucose, galactose, manose) | 1. Ácido Hialurónico |
| 2. oligossacáridos (maltose, lactose, sacarose) | 2. ácido condroitina. |
| 3. Os derivados amino acetilados de monossacarídeos | 3. A heparina |
| 4. Dezoksisaharidy | |
| 5. ácido neuramínico e siálico | |
metaloproteínas
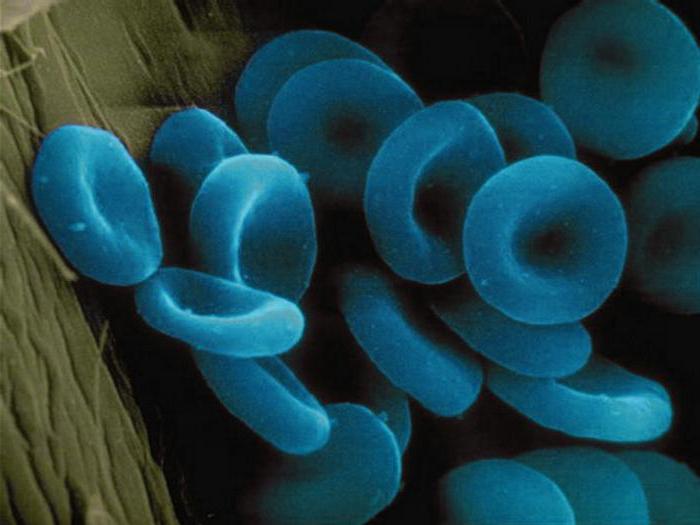
Estes materiais contêm, como parte do seu ião molecular de um ou mais metais. Considere os exemplos de proteínas complexas que pertencem ao grupo acima. É acima de todas as enzimas tais como citocromo-oxidase. Ele está situado na cristas da mitocôndria e ativa a síntese de ATP. Ferrin e transferrina – proteid contendo iões de ferro. depósitos origem eles nas células, e o segundo é o transporte das proteínas do sangue. Outro metaloproteínas – alfaamelaza que contém iões de cálcio é incluído na composição da saliva e suco pancreático, participando na divisão de amido. A hemoglobina é a forma como metaloproteínas e hromoproteidov. Ele serve como uma proteína de transporte que transporta oxigênio. O resultado é um composto de oxi-hemoglobina. A inalação de monóxido de carbono, ou monóxido de carbono-chamada, as suas moléculas de hemoglobina formar eritrócitos compostos muito estáveis. Ele se espalha rapidamente para órgãos e tecidos, causando intoxicação celular. Como resultado, após a inalação prolongada de morte monóxido de carbono ocorre a partir de asfixia. Hemoglobina parcialmente carrega e dióxido de carbono formados nos processos catabólicos. A partir da corrente sanguínea de dióxido de carbono para os pulmões e nos rins, e a partir deles – para o ambiente externo. Alguns crustáceos e moluscos proteína de transporte que transporta o oxigênio, é o buraco da fechadura. Em vez do ferro que contém iões de cobre, de modo que o sangue dos animais não é vermelho e azul.
função de clorofila
Como mencionado anteriormente, as proteínas complexas podem formar complexos com pigmentos coloridos – substâncias orgânicas. Sua cor depende grupos hromoformnyh que absorvem seletivamente certas espectros de luz solar. Nas células vegetais tem plastídios verdes – cloroplastos contêm clorofila pigmento. É composto por átomos de magnésio e um álcool poli-hídrico, fitol. Eles estão associados com moléculas de proteína, e contêm em si mesmos cloroplastos tilacóides (placas) ou membrana associadas em pilhas – faceta. Eles são pigmentos fotossintéticos – clorofila – e carotenóides adicionais. Aqui estão todas as enzimas usadas nas reações de fotossíntese. Assim chromoproteids, que incluem clorofila, executar funções críticas no metabolismo, designadamente nas reacções de assimilação e dissimilação.
proteínas virais
Eles incluem representantes de formas não-celulares de vida, entrar no reino de Vir. Os vírus não têm seu próprio aparelho de sintetizar proteínas. Os idos nucleicos, ADN ou ARN, podem induzir a síntese da maior parte das partículas próprias células infectadas com vírus. Os vírus simples consistir apenas de moléculas de proteína, de forma compacta montados em uma estrutura helicoidal ou uma forma de poliedros, tais como o vírus do mosaico do tabaco. vírus complexos têm membrana adicional que faz parte da membrana do plasma da célula hospedeira. Como pode incluir glicoproteínas (vírus da hepatite B, vírus da varíola). A principal função das glicoproteínas – um reconhecimento de receptores específicos na membrana da célula hospedeira. A composição das membranas virais e proteínas adicionais incluem enzimas que fornecem reduplicação de ADN ou transcrição do ARN. Com base no acima exposto, pode-se concluir o seguinte: proteínas virais de partículas conchas têm uma estrutura específica, dependendo das proteínas da membrana da célula hospedeira.
Neste artigo, foram dadas as características de proteínas complexas, estudou a sua estrutura e função em células de vários organismos.














