Propriedades químicas dos metais alcalino-terrosos. Uso de metais alcalino-terrosos. As propriedades físicas do metal alcalino-terroso
Considere as propriedades químicas dos metais alcalino-terrosos. Definir as características de sua estrutura, recebendo, estando na natureza, aplicação.
A situação na SS
Para definir o local de início de estes elementos na tabela periódica de Mendeleev. Eles estão localizados no segundo grupo dos principais subgrupos. Estes incluem cálcio, estrôncio, rádio, bário, magnésio, berílio. Todos eles estão no nível de energia externa contém dois elétrons de valência. Em termos gerais, os metais de berílio, magnésio e alcalino-terrosos são externamente electrões ns2. Os compostos químicos que exibam o estado de oxidação dois. Durante a interacção com outras substâncias, que exibem propriedades redutoras, dando electrões de um nivel de energia externa.

alterando propriedades
Com o aumento do átomo de berílio núcleo, magnésio e metais alcalino-terrosos melhorar as suas propriedades metálicas, uma vez que existe um aumento no raio dos seus átomos. Considere as propriedades físicas dos metais alcalino-terrosos. Berílio estiver no estado normal é um metal com um gray luster aço. Ele tem uma estrutura de cristal hexagonal denso. Em contacto com o oxigénio, berílio imediatamente formar uma película de óxido, reduzindo assim a sua reactividade, revestimento mate formado.
Propriedades físicas
O magnésio como uma substância simples é um metal branco que forma o revestimento de óxido no ar. Ele tem uma estrutura de cristal hexagonal.
As propriedades físicas do cálcio metais alcalino-terrosos, bário, estrôncio semelhante. Eles representam metais típicos com brilho prateado, cobrir sob a influência de película amarelada de oxigénio no ar. No cálcio e estrôncio rede cúbica face centrada, bário tem uma estrutura de corpo centrado.
metal de terra alcalina química com base no facto de que eles têm uma natureza metálica da relação. É por isso que eles são caracterizados pela alta condutividade elétrica e calor. As temperaturas de pontos de fusão e de ebulição maior do que a dos metais alcalinos.

Os métodos para a preparação
produção berílio em escala industrial é levada a cabo pela redução do fluoreto de metal. A condição do fluxo da reacção química é o pré-aquecimento.
Dado que, na natureza dos metais alcalino-terrosos são, sob a forma de compostos de magnésio, estrôncio, cálcio conduta electrólise dos fundidos de seus sais.

Propriedades químicas
Propriedades químicas dos metais alcalino-terrosos são associados com a necessidade de eliminar antes da sua superfície uma camada de película de óxido. Ele determina a inércia desses metais para a água. Cálcio, bário, estrôncio, quando dissolvido em água para formar hidróxidos tendo pronunciado propriedades básicas.
Propriedades químicas dos metais alcalino-terrosos assumir a sua interacção com o oxigénio. Para o produto de reacção de peróxido de bário é, por todos os outros óxidos formados, após a reacção. Todos os membros desta classe de óxidos apresentam propriedades básicas, apenas de óxido de berílio propriedades características anfotéricos.
Propriedades químicas dos metais alcalino-terrosos são mostrados e na reacção com o enxofre, halogéneo, azoto. Quando se observa a reacção com uma dissolução ácida destes elementos. Dado que berílio refere-se a elementos anfotéricos, que é capaz de reagir quimicamente com álcalis.

reacções qualitativos
fórmulas básicos de metais alcalino-terrosos, viram no decurso de química inorgânica associada com sais. Para identificar os membros desta classe em combinação com outros elementos, você pode usar a determinação qualitativa. Ao aplicar o sal de metal alcalino-terroso em chama álcool-lâmpada, a coloração observada chama catiões. cação de estrôncio dá uma tonalidade vermelha escura, o cátion de cálcio – laranja e verde tom de bário cação.
Para identificar catião de bário utilizado em aniões sulfato análise qualitativa. Como resultado desta reacção de um sulfato de bário branca que é insolúvel em ácidos minerais.
O rádio é um elemento radioactivo que contém na natureza em quantidades menores. Quando a reacção de magnésio com o oxigénio, não há um flash brilhante. Este processo é utilizado por algum tempo ao tirar fotos em locais escuros. Agora substitua o flash de magnésio veio o sistema elétrico. A família dos metais alcalino-terrosos refere-se berílio, que se faz reagir com muitos produtos químicos. Cálcio e de magnésio e alumínio de modo semelhante, pode recuperar metais raros, tais como titânio, tungsténio, molibdénio e de nióbio. Estes processos para metais obtenção referido kaltsietermiey e magnietermiey.

Recursos do aplicativo
O que é o uso de metais alcalino-terrosos? O cálcio e o magnésio são utilizados para o fabrico de ligas leves e metais raros.
Por exemplo, o magnésio está contido na composição de duralumínio, e cálcio – um componente de ligas de chumbo utilizadas para preparar as bainhas de cabo e rolamentos criando. Amplamente usar de metal alcalino-terroso na técnica sob a forma de óxidos. cal apagada (óxido de cálcio) e queimada magnésio (óxido de magnésio) são necessários para o sector da construção.
Na reacção do óxido de cálcio com a água é libertada uma quantidade significativa de calor. cal apagada (hidróxido de cálcio) é utilizado para a construção. A suspensão branca da substância (leite de cal) é utilizado na indústria de açúcar para o processo de purificação de suco de beterraba.
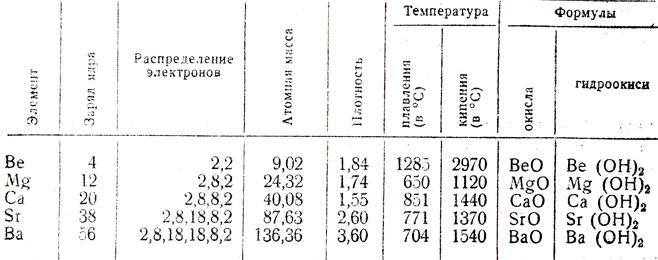
Os sais dos metais do segundo grupo
sais de magnésio, berílio, metais alcalino-terrosos podem ser preparados por reacção com ácidos dos respectivos óxidos. Cloretos, fluoretos, iodetos de elementos de dados são compostos cristalinos brancos, geralmente bem solúvel em água. Entre os sulfatos de ter solubilidade única de magnésio e composto de berílio. Observa-se uma diminuição de sais de berílio com sulfato de bário. Carbonatos são praticamente insolúveis em água ou possuir uma solubilidade mínima.
Os sulfuretos de metais de terras alcalinas estão contidos em pequenas quantidades de metais pesados. Se você enviá-los para a luz, você pode obter uma variedade de cores. Sulfetos estão incluídas nas composições luminescentes, chamado de fósforos. Aplicar estas cores para criar mostradores luminosos, sinais de trânsito.
compostos comuns de metais alcalino-terrosos
O carbonato de cálcio é o elemento mais abundante na superfície da Terra. Faz parte dos compostos, tais como o calcário, mármore, greda. Entre eles, o principal uso é calcário. Este mineral é indispensável na construção, é considerado um excelente pedra de construção. Além disso, os presentes compostos são cal viva inorgânico e cal apagada, vidro e cimento.
O uso de cascalho calcário contribui para a estrada, mas porque o pó pode reduzir a acidez do solo. giz Natural é uma concha animais mais velhos. Este composto é utilizado para o fabrico de borracha, papel, a criação de pastéis escolares.
demanda mármore de arquitetos, escultores. Ele é feito de mármore foram criadas muitas obras únicas de Michelangelo. Parte das estações do metrô de Moscou é forrado com telhas de mármore. O carbonato de magnésio é usado em grandes quantidades no fabrico de tijolos, cimento, vidro. Ela é necessária na indústria metalúrgica para a remoção de resíduos de rocha.
sulfato de cálcio contido naturalmente na forma de gesso (sulfato de cálcio cristalino) é usado na indústria da construção. Em medicina, o composto é utilizado para a produção de moldes, e para a produção de ligaduras de gesso.
Estuque (gesso semi-hidratado) por reacção com a água liberta uma enorme quantidade de calor. Ele também é usado na indústria.
sal de Epsom (sulfato de magnésio), utilizados em medicina como um laxante. Esta substância tem um sabor amargo, é encontrado na água do mar.
"Papa de aveia barita" (sulfato de bário) não é solúvel em água. É por isso que este sal é usado em radiologia. Sal detém os raios-X que podem detectar doenças do trato gastrointestinal.
A composição de fosfato de rocha (pedra) e fosfato de cálcio é de apatite. Eles precisam para produzir compostos de cálcio: óxidos, hidróxidos.
O cálcio desempenha para os organismos de particular importância vivo. É este metal é essencial para a construção de esqueleto do osso. Os iões cálcio são necessários para o ajustamento do coração, aumentar a coagulação do sangue. Falta dela causa um mau funcionamento do sistema nervoso, perda de coagulação, perda da capacidade de entregar normalmente mantêm uma variedade de itens.
A fim de evitar problemas de saúde, a cada dia deve consumir cerca de 1,5 gramas de cálcio. O principal problema reside no facto de para o corpo a absorver 0,06 gramas de cálcio deve comer um grama de gordura. A quantidade máxima de metal contido na alface, salsa, requeijão, queijo.

conclusão
Todos os representantes do segundo grupo da tabela periódica do principal subgrupo necessário para a vida e obra do homem moderno. Por exemplo, o magnésio é um estimulador de processos metabólicos no corpo. Ele deve estar presente no tecido nervoso, sangue, osso, fígado. O magnésio é um participante activo e fotossíntese em plantas, uma vez que é parte da clorofila. Ossos humanos são cerca de um quinto do peso total. Que contêm cálcio e magnésio. Óxidos, sais de metais alcalino-terrosos têm encontrado várias aplicações na indústria da construção, farmacêutica e da medicina.













