soluções de electrólitos são líquidos especiais que são parcialmente ou completamente sob a forma de partículas com carga (iões). O próprio processo de fraccionamento das moléculas na negativamente (aniões) e (catiões) partículas carregadas positivamente chamados dissociação electrolítica. A dissociação em solução só é possível devido à capacidade dos iões de interagir com as moléculas do líquido polar o qual actua como um solvente.
O que são eletrólitos
 soluções de electrólitos são divididos em aquosa e não-aquosa. Água estudou muito bem e foram muito difundida. Eles estão em quase todos os organismos vivos e está ativamente envolvido em muitos processos biológicos importantes. electrólitos não-aquosas para aplicar processos electroquímicos e uma variedade de reacções químicas. Seu uso levou à invenção de novas fontes de energia química. Eles desempenham um papel importante em células fotoeletroquímicas, síntese orgânica, capacitores eletrolíticos.
soluções de electrólitos são divididos em aquosa e não-aquosa. Água estudou muito bem e foram muito difundida. Eles estão em quase todos os organismos vivos e está ativamente envolvido em muitos processos biológicos importantes. electrólitos não-aquosas para aplicar processos electroquímicos e uma variedade de reacções químicas. Seu uso levou à invenção de novas fontes de energia química. Eles desempenham um papel importante em células fotoeletroquímicas, síntese orgânica, capacitores eletrolíticos.
As soluções de electrólitos, dependendo do grau de dissociação pode ser dividido em forte, média e fraca. grau de dissociação (α) – é a relação entre as moléculas quebradas em partículas carregadas para o número total de moléculas. Em electrólitos fortes valor alfa perto de 1, no α≈0,3 meio, e a fraco α <0,1.
Por geralmente electrólitos fortes incluem sais, vários de certos ácidos – HCl, HBr, HI, HNO 3, H 2 SO 4, HClO4, hidróxidos de bário, estrôncio, cálcio e metais alcalinos. Outra base e ácido – meio electrólito ou força fraca.
soluções eletrolíticas Propriedades
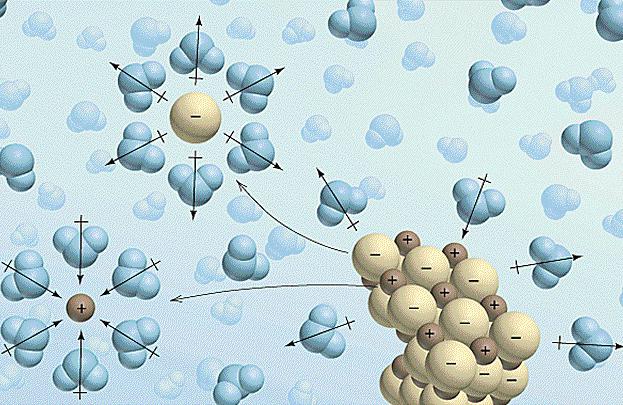 soluções de educação são frequentemente acompanhadas por efeitos térmicos e mudanças no volume. O processo de dissolução do electrólito no fluido tem lugar em três estágios:
soluções de educação são frequentemente acompanhadas por efeitos térmicos e mudanças no volume. O processo de dissolução do electrólito no fluido tem lugar em três estágios:
- A destruição de ligações químicas e electrólito dissolvido intermolecular requer custa de uma certa quantidade de energia e, por conseguinte, a absorção de calor ocorre (bit? H> 0).
- Neste passo, o solvente começa a interagir com os iões de electrólitos, resultando na formação de solvatos (em solução aquosa – hidratos). Este processo é conhecido e é solvatação exotérmica, isto é, exotérmica ocorre (Δ H hidr <0).
- A última etapa – difusão. Esta distribuição uniforme de hidratos (solvatos) em solução em massa. Este processo requer o gasto de energia e, por conseguinte, a solução é arrefecida (diferencial? H> 0).
Assim, o efeito térmico total de dissolução do electrólito pode ser escrito sob a forma seguinte:
Sol? H =? + H? H descarga diferencial hidráulico? H +
A partir daí, quais seriam os componentes dos efeitos da energia depende da classificação final do calor total de dissolução do efeito eletrólito. Normalmente, este processo é endotérmico.
 Propriedades da solução depende principalmente da natureza dos seus componentes constituintes. Além disso, as propriedades da composição da solução de electrólito é influenciada, pressão e temperatura.
Propriedades da solução depende principalmente da natureza dos seus componentes constituintes. Além disso, as propriedades da composição da solução de electrólito é influenciada, pressão e temperatura.
Dependendo do conteúdo de todas as soluções de soluto electrolíticas podem ser divididas em muito diluído (em que apenas contém "vestígios" de electrólitos), diluído (contendo uma pequena quantidade de soluto) e concentrada (com um teor significativo de electrólito).
As reacções químicas em solues de electrito, que são causadas pela passagem de corrente eléctrica conduz ao isolamento de determinados materiais para os eléctrodos. Este fenômeno é chamado eletrólise e é frequentemente utilizado na indústria moderna. Em particular, devido à electrólise obtidos de alumínio, hidrogénio, cloro, hidróxido de sódio, peróxido de hidrogénio, e muitas outras substâncias importantes.














