Qual é a valência do enxofre? Possíveis valências de enxofre
O enxofre (enxofre latino) é um elemento não metálico. O símbolo químico S, o número ordinal na tabela periódica – 16. A valência do enxofre foi estabelecida mesmo antes do estudo da estrutura do átomo. Determinou seu valor com base na propriedade para substituir, atrair ou anexar vários outros átomos ou grupos. Mais tarde, os pesquisadores descobriram o papel das partículas carregadas negativamente (elétrons) na origem da ligação química.
Valência do enxofre: quais características dos átomos afetam seu significado?
Pela prevalência na Terra, o elemento químico está no 16º lugar. Ocorre sob a forma de cristais ou pó brilhantes em rochas, perto de vulcões ativos e extintos. Os compostos naturais mais famosos são sulfetos e sulfatos.

Características do elemento e da substância:
- Forte não metálico.
- Por eletronegatividade (EO) ou a capacidade de atrair elétrons para si próprio, o enxofre é o segundo apenas para flúor, oxigênio, nitrogênio, cloro e bromo.
- Interage com metais e não metais, substâncias simples e complexas.
As diferenças nas propriedades dependem da estrutura e do estado do átomo, a diferença nos valores de EO. Deixe-nos descobrir o que a valência pode estar presente no enxofre nos compostos. Seu comportamento químico depende da estrutura dos reservatórios de energia, do número e da localização dos elétrons externos no átomo.
Por que a valência é diferente?
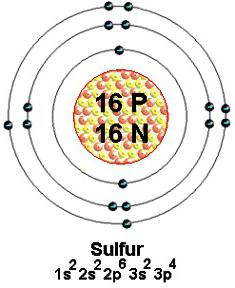 Os isótopos naturais estáveis de enxofre com números de massa 32 (o mais comum), 33, 34 e 36 são estáveis. O átomo de cada um desses nuclídeos contém 16 prótons carregados positivamente. No espaço perto do núcleo, 16 elétrons movem-se com uma velocidade enorme. Eles são infinitamente pequenos, carregados negativamente. Menos de 6 partículas externas são atraídas para o núcleo (mais livre). Vários deles ou todos participam da formação de diferentes tipos de ligações químicas. De acordo com conceitos modernos, a valência do enxofre é determinada pelo número de pares de elétrons comuns (vinculativos) criados. Normalmente, em desenhos e diagramas, as partículas externas que participam desse processo são representadas por pontos ao redor do sinal químico.
Os isótopos naturais estáveis de enxofre com números de massa 32 (o mais comum), 33, 34 e 36 são estáveis. O átomo de cada um desses nuclídeos contém 16 prótons carregados positivamente. No espaço perto do núcleo, 16 elétrons movem-se com uma velocidade enorme. Eles são infinitamente pequenos, carregados negativamente. Menos de 6 partículas externas são atraídas para o núcleo (mais livre). Vários deles ou todos participam da formação de diferentes tipos de ligações químicas. De acordo com conceitos modernos, a valência do enxofre é determinada pelo número de pares de elétrons comuns (vinculativos) criados. Normalmente, em desenhos e diagramas, as partículas externas que participam desse processo são representadas por pontos ao redor do sinal químico.
Como a valência depende da estrutura do átomo?
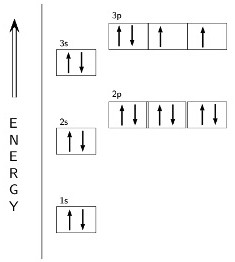 Usando o diagrama de energia, é possível mostrar a estrutura de níveis e sub-níveis (s, p, d) em que depende a fórmula de valência do enxofre. Duas setas dirigidas de forma diferente simbolizam os elétrons emparelhados e não-separados. O espaço exterior do átomo de enxofre forma os orbitais de 6 partículas, mas 8 é necessário para a estabilidade de acordo com a regra do octeto. A configuração do invólucro de valência reflete a fórmula 3s23p4. Os elétrons da camada incompleta possuem uma grande reserva de energia, o que provoca o estado instável de todo o átomo. Para alcançar a estabilidade, o átomo de enxofre requer duas partículas negativas adicionais. Eles podem ser obtidos formando ligações covalentes com outros elementos ou absorvendo dois elétrons livres. Neste caso, o enxofre exibe uma valência II (-). O mesmo valor pode ser obtido usando a fórmula: 8 – 6 = 2, onde 6 é o número do grupo no qual o elemento está localizado.
Usando o diagrama de energia, é possível mostrar a estrutura de níveis e sub-níveis (s, p, d) em que depende a fórmula de valência do enxofre. Duas setas dirigidas de forma diferente simbolizam os elétrons emparelhados e não-separados. O espaço exterior do átomo de enxofre forma os orbitais de 6 partículas, mas 8 é necessário para a estabilidade de acordo com a regra do octeto. A configuração do invólucro de valência reflete a fórmula 3s23p4. Os elétrons da camada incompleta possuem uma grande reserva de energia, o que provoca o estado instável de todo o átomo. Para alcançar a estabilidade, o átomo de enxofre requer duas partículas negativas adicionais. Eles podem ser obtidos formando ligações covalentes com outros elementos ou absorvendo dois elétrons livres. Neste caso, o enxofre exibe uma valência II (-). O mesmo valor pode ser obtido usando a fórmula: 8 – 6 = 2, onde 6 é o número do grupo no qual o elemento está localizado.
Onde estão os compostos nos quais a valência do enxofre é II (-)?
 O elemento atrai ou remove completamente os elétrons dos átomos com um valor de eletronegatividade inferior na escala Polling. Valence II (-) manifesta-se nos sulfetos de metais e não metais. Um grupo extensivo de tais compostos é encontrado em rochas e minerais de grande importância prática. Estes incluem pirita (FeS), esferalerita (ZnS), galena (PbS) e outras substâncias. Os cristais de sulfato de ferro têm uma linda cor amarelada e brilham. Muitas vezes, o mineral da pirita é chamado de "ouro dos tolos". Para obter metais de minérios, eles são queimados ou regenerados. O sulfato de hidrogênio H2S tem a mesma estrutura eletrônica que a água. H2S Origem:
O elemento atrai ou remove completamente os elétrons dos átomos com um valor de eletronegatividade inferior na escala Polling. Valence II (-) manifesta-se nos sulfetos de metais e não metais. Um grupo extensivo de tais compostos é encontrado em rochas e minerais de grande importância prática. Estes incluem pirita (FeS), esferalerita (ZnS), galena (PbS) e outras substâncias. Os cristais de sulfato de ferro têm uma linda cor amarelada e brilham. Muitas vezes, o mineral da pirita é chamado de "ouro dos tolos". Para obter metais de minérios, eles são queimados ou regenerados. O sulfato de hidrogênio H2S tem a mesma estrutura eletrônica que a água. H2S Origem:
- É liberado quando decomposição de proteínas (por exemplo, o ovo de uma galinha);
- Erupta com gases vulcânicos;
- Acumula-se em águas naturais, óleo;
- É emitido em vazios na crosta terrestre.
Por que a fórmula do óxido de SO2 tetravalente de enxofre?
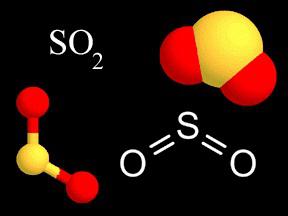 A fórmula de dióxido mostra que um átomo de enxofre em uma molécula está ligado a dois átomos de oxigênio, cada um dos quais exige 2 elétrons para um octeto. A ligação resultante é, por natureza, covalente polar (EO de oxigênio é maior). A valência do enxofre neste composto tem o valor IV (+), porque 4 elétrons do átomo de enxofre são deslocados para dois átomos de oxigênio. A fórmula pode ser escrita da seguinte forma: S2O4, mas pelas regras é necessário reduzir em 2. O dióxido, quando dissolvido na água, forma íons de ácido sulfúrico fraco. Seus sais – sulfitos – são agentes redutores fortes. O gás SO2 serve como intermediário na produção de ácido sulfúrico.
A fórmula de dióxido mostra que um átomo de enxofre em uma molécula está ligado a dois átomos de oxigênio, cada um dos quais exige 2 elétrons para um octeto. A ligação resultante é, por natureza, covalente polar (EO de oxigênio é maior). A valência do enxofre neste composto tem o valor IV (+), porque 4 elétrons do átomo de enxofre são deslocados para dois átomos de oxigênio. A fórmula pode ser escrita da seguinte forma: S2O4, mas pelas regras é necessário reduzir em 2. O dióxido, quando dissolvido na água, forma íons de ácido sulfúrico fraco. Seus sais – sulfitos – são agentes redutores fortes. O gás SO2 serve como intermediário na produção de ácido sulfúrico.
Em que substâncias o enxofre mostra sua maior valência?
 SO3 óxido ou S2O6 é um líquido incolor, a temperaturas inferiores a 17 ° C, endurece. No composto SO3, a valência de oxigênio é II (-), e o enxofre VI (+). O óxido superior se dissolve na água e forma um forte ácido sulfúrico dibásico. Para um papel maior nos processos de produção, a substância foi chamada de "pão da indústria química". Um papel importante na economia e na medicina pertence aos sais ácidos – sulfatos. É utilizado hidrato cristalino de cálcio (gesso), sódio (sal de Glauber), magnésio (sal inglês ou amargo).
SO3 óxido ou S2O6 é um líquido incolor, a temperaturas inferiores a 17 ° C, endurece. No composto SO3, a valência de oxigênio é II (-), e o enxofre VI (+). O óxido superior se dissolve na água e forma um forte ácido sulfúrico dibásico. Para um papel maior nos processos de produção, a substância foi chamada de "pão da indústria química". Um papel importante na economia e na medicina pertence aos sais ácidos – sulfatos. É utilizado hidrato cristalino de cálcio (gesso), sódio (sal de Glauber), magnésio (sal inglês ou amargo).
Na formação de diferentes tipos de ligação química, 1, 2, 3, 4, 6 elétrons externos podem participar. Chamamos as possíveis valências do enxofre, levando em conta que existem compostos raros e instáveis: I (-), II (-), II (+), III (+), IV (+), VI (+). O segundo elemento de valência positivo é obtido em monóxido de SO. Os valores mais comuns de II (-), IV (+), VI (+) mostram enxofre em um grupo de substâncias com significado industrial, agrícola e médico. Suas conexões são usadas na produção de fogos de artifício.

Um grande problema é a captura de gases residuais, entre os quais os óxidos de enxofre IV (+), VI (+) e sulfeto de hidrogênio prejudiciais ao homem e ao meio ambiente. Foram desenvolvidas tecnologias para o processamento desses resíduos gasosos e a obtenção de ácido sulfúrico e sulfatos deles. Para este fim, as plantas químicas são construídas perto de plantas metalúrgicas ou em uma área. Como resultado, o volume de contaminantes é reduzido, menos "chuva de ácido sulfúrico" ocorre.














