EXEMPLO ligação covalente não polar. ligação covalente polar e não polar
Um papel significativo no nível de organização química do mundo desempenha um método de comunicação partículas estruturadas, entre os compostos. O grande número de substâncias simples, ou seja, não metais são não polar tipo de ligação covalente, excepto para os gases inertes. Metais na forma pura tem nomeadamente método de comunicação que é realizado por socialização de electrões livres na estrutura de cristal.
Todas as substâncias complexas (excepto para algum orgânica) são ligações químicas covalentes polares. Tipos e exemplos destes compostos são discutidas abaixo. Nesse meio tempo, conhecer as características de um átomo afeta a polarização comunicação.
eletronegatividade
Átomos, e mais especificamente o seu núcleo (que, como se sabe, são carregados positivamente), ter a capacidade para atrair e manter a densidade de electrões, em particular, a formação de ligações químicas. Esta propriedade foi chamado eletronegatividade. A Tabela Periódica seu valor cresce em períodos e os principais elementos dos subgrupos. valor de electronegatividade nem sempre é constante e pode variar, por exemplo, mudando o tipo de hibridação, que entra orbitais.
As ligações químicas, tipos e exemplos dos quais estão listados abaixo, e mais especificamente, a localização ou deslocamento parcial desses contactos para um dos participantes de ligação é explicado pela característica electronegativa de um elemento em particular. Deslocamento ocorre ao átomo, que é mais forte.
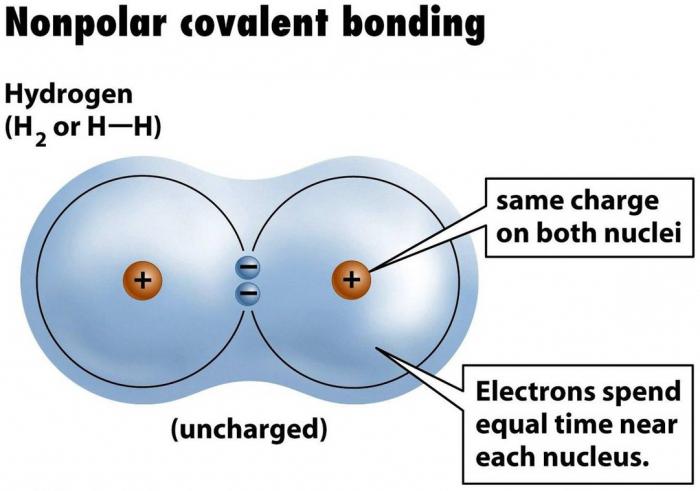
ligação covalente não polar
"" Fórmula ligações covalentes simples não polares – dois átomos de mesma natureza são combinados em conjunto com um par de electrões de valência suas conchas. Esse par é chamado de uma dividida porque ele pertence a ambas as partes igualmente vinculativos. É através da densidade de electrões socialização, sob a forma de um par de electrões, átomos de mover-se em um estado estável, uma vez que completa o seu nível de electrões externo, e "octeto" (ou "dupleto", no caso de uma substância simples de hidrogénio H2, ele só s-orbital, para conclusão de que precisa de dois electrões) – um estado do nível externo, à qual todos os átomos, como corresponde ao enchimento do estado com energia mínima. 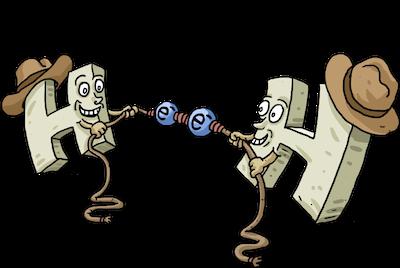
Um exemplo de uma ligação covalente não polar é nos inorgânicos e, estranho que possa parecer, mas também em química orgânica, também. Este tipo de ligação é comum a todas as substâncias simples – com excepção dos gases nobres não-metais, como nível de valência do átomo de gás inerte e já completou octeto de electrões, e ligando-se, por conseguinte, com semelhante não tem qualquer significado para ele, e ainda menos energeticamente favorável. Na matéria orgânica não-polaridade encontrado em alguns estrutura particular da molécula, e é condicional.
ligação covalente polar
ligação covalente não polar EXEMPLO limitado a algumas moléculas de uma substância simples, enquanto que os compostos de dipolos em que a densidade de electrões é parcialmente deslocada para um elemento mais electronegativo, – uma maioria esmagadora. Qualquer combinação de átomos com valor de electronegatividade diferente dá ligação polar. Em particular, devido à matéria orgânica – uma ligação covalente polar. Às vezes iónicos óxidos inorgânicos também são polares, e sais de ácidos e de ligação iónica predomina tipo.
Tal como um caso extremo da ligação polar, por vezes, tratada e os compostos do tipo iónicos. Se a electronegatividade de um dos elementos é significativamente maior do que a outra, um par de electrões é completamente deslocado do centro da comunicação ao mesmo. Portanto, há uma divisão em íons. Qualquer pessoa que pega um par de elétrons, é convertido em um ânion e recebe uma carga negativa, ea perda de um elétron – é transformado em um cátion e tornar-se positivo. 
Exemplos de substâncias inorgânicas com um tipo de ligação covalente não polar
As substâncias com ligação covalente apolar – é, por exemplo, todas as moléculas de gás binários: hidrogénio (H – H), oxigénio (= O), azoto (na sua molécula 2 átomos ligados ligação tripla (N ≡ N)); líquidos e substâncias sólidas: cloro (Cl – Cl), flúor (F – F), bromo (Br – Br), iodo (I – I). Também substâncias complexas consistindo de átomos de elementos diferentes, mas com o mesmo valor real de electronegatividade, por exemplo, hidreto de fósforo – PH 3.
Orgânico não polar e de ligação
Claro que todos matéria orgânica complexa. A pergunta é, como pode haver uma ligação apolar em um assunto complexo? A resposta é bastante simples, se um pouco o pensamento lógico. Se os valores de electronegatividade elementos relacionados diferem ligeiramente e não crie um momento de dipolo no composto, tal ligação pode ser considerado como não-polar. Esta é a situação com o carbono e hidrogénio: todos C – ligaes H na matéria orgânica são considerados não-polar.
EXEMPLO ligação covalente não polar – molécula de metano, o mais simples composto orgânico. É constituída por um átomo de carbono, o qual, de acordo com a sua valência, ligados por ligações simples a quatro átomos de hidrogénio. Na verdade, a molécula não é um dipolo, já que não há localização de carga em alguma coisa e às custas da estrutura tetraédrica. A densidade de electrões é distribuído uniformemente. 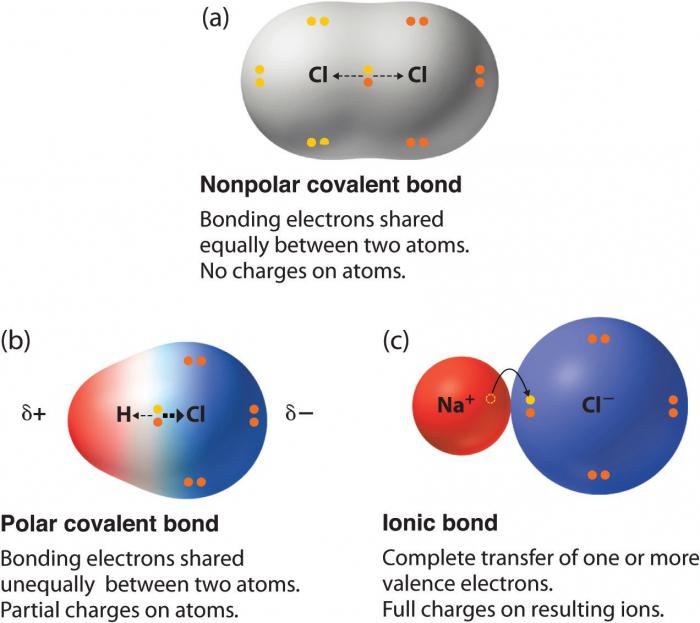
Um exemplo de uma ligação covalente não polar é em compostos orgânicos mais complexos. Ele é realizado à custa de efeitos mesomérico, isto é, a densidade de electrões puxar consistente, que rapidamente extinto pela cadeia de carbono. Assim, na molécula de ligação hexacloroetano C – C não polar devido ao puxar uniforme de electrões densidade seis átomos de cloro.
Outros tipos de ligações
Em adição a uma ligação covalente, a qual, aliás, pode ser levada a cabo sobre o mecanismo de dador-aceitador, existem ligações iónicas, metálicas e de hidrogénio. características breves penúltimo dois apresentaram acima. 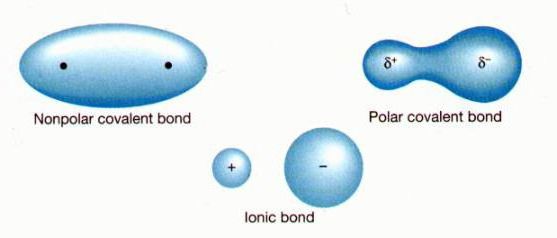
Hidrogénio ligação – é a interacção intermolecular electrostático, que pode ocorrer se houver um átomo da molécula e quaisquer outras de hidrogénio ter pares de electrões não partilhados. Este tipo de ligação é muito mais fraco do que os outros, mas, devido ao facto da substância de estas ligações podem ser formadas muito, contribui significativamente para as propriedades do composto.