Alcanês, alcenos, alcinos são produtos químicos orgânicos. Todos eles são construídos de elementos químicos, como carbono e hidrogênio. Alcanês, alcenos, alcinos são compostos químicos que pertencem a um grupo de hidrocarbonetos.
Neste artigo, veremos alkynes.
O que é isso?
Estas substâncias são também chamadas de hidrocarbonetos acetilénicos. A estrutura dos alcinos prevê a presença de átomos de carbono e hidrogênio em suas moléculas. A fórmula geral dos hidrocarbonetos de acetileno é: C n H 2n-2 . O alquimio simples mais simples é a etina (acetileno). Ele tem esta fórmula química – C 2 H 2 . Além disso, alkynes incluem propyne com a fórmula C 3 H 4 . Além disso, butino (C4H6), pentina (C5H8), hexina (C6H10), heptina (C7H12), octina (C8H14), nonina ( C 9 H 16 ), decin (C 10 H 18 ), etc. Todos os tipos de alquins têm características semelhantes. Vamos ver mais detalhadamente. 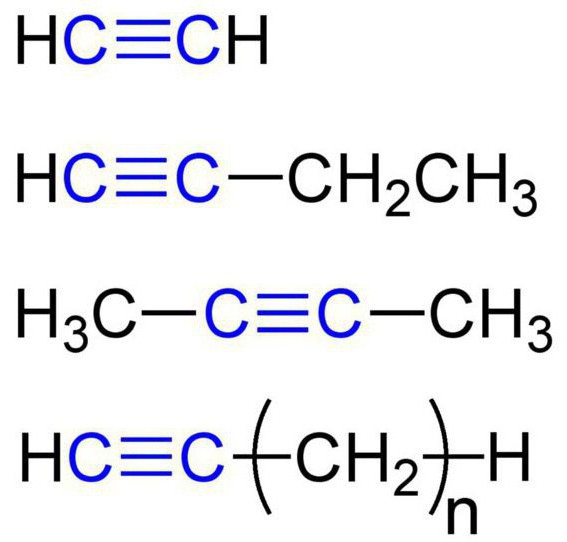
Propriedades físicas dos alquimatos
De acordo com suas características físicas, os hidrocarbonetos de acetileno são semelhantes aos alcenos.
Em condições normais, os alquinos, cujas moléculas contêm de dois a quatro átomos de carbono, têm um estado agregado gasoso. Aqueles em cujas moléculas existem de cinco a 16 átomos de carbono, em condições normais de fluido. Aqueles cujas moléculas contêm 17 ou mais átomos deste elemento químico são sólidos.
As alcalinas derretem e fermentam a uma temperatura mais alta do que alcanos e alcenos.
A solubilidade na água é insignificante, mas ligeiramente superior à dos alcenos e alcanos.
A solubilidade em solventes orgânicos é alta.
O alquino – acetileno mais utilizado – tem tais propriedades físicas:
- Não tem cor;
- Não tem cheiro;
- Em condições normais é em estado agregado gaseoso;
- Tem uma densidade mais baixa do que o ar;
- O ponto de ebulição é de menos 83,6 graus Celsius;
Propriedades químicas dos alquimatos
Nessas substâncias, os átomos estão conectados por uma ligação tripla, o que explica suas propriedades básicas. Alkines entram em reações deste tipo:
- Hidrogenação;
- Hidro-halogenação;
- Halogenação;
- Hidratação;
- Queimando.
Vamos olhar para eles em ordem. 
Hidrogenação
As propriedades químicas dos alquinos permitem que eles entrem em reações deste tipo. Este é um tipo de interação química, na qual uma molécula de matéria atribui átomos adicionais de hidrogênio a si mesmo. Aqui está um exemplo de tal reação química no caso do propeno:
2H2 + C3H4 = C3H8
Essa reação ocorre em duas etapas. Na primeira molécula de propeno acrescenta dois átomos de hidrogênio e o segundo – tanto quanto.
Halogenação
Esta é outra reação que faz parte das propriedades químicas dos alquins. Como resultado, a molécula do hidrocarboneto de acetileno atribui os átomos de halogéneo. Estes incluem elementos como cloro, bromo, iodo, etc.
Aqui está um exemplo de tal reação no caso de ethyn:
C 2 H 2 + 2 CI 2 = C 2 H 2 CI 4
O mesmo processo é possível com outros hidrocarbonetos acetilénicos.
Hidrohalogenação
Esta é também uma das principais reações, que faz parte das propriedades químicas dos alquinos. Consiste no fato de que a substância interage com compostos como HCl, HI, HBr, etc. Esta interação química ocorre em duas etapas. Consideremos uma reação deste tipo com o exemplo de Ethyne:
C 2 H 2 + HCI = C 2 H 3 CI
С 2 Н 2 СІ + НСІ = С 2 Н 4 СІ 2 
Hidratação
Esta é uma reação química, que consiste na interação com a água. Também acontece em duas etapas. Vejamos isso com o exemplo de ethyn:
H 2 O + C 2 H 2 = C 2 H 3 OH
A substância que é formada após o primeiro estágio da reação é chamada de álcool vinílico.
Devido ao fato de que, de acordo com a regra de Eltekov, o grupo funcional OH não pode estar localizado ao lado da ligação dupla, há um rearranjo dos átomos, pelo que o acetaldeído é formado a partir de álcool vinílico.
O processo de hidratação de alquinos também é chamado de reação de Kucherov. 
Queimando
Este é o processo de interação de alquinos com oxigênio a alta temperatura. Consideremos a queima de substâncias deste grupo com o exemplo de acetileno:
2C2H2 + 2O2 = 2H2O + 3C + CO 2
Com um excesso de oxigênio, acetileno e outros alquinos queimam sem a formação de carbono. Somente monóxido de carbono e água são liberados. Aqui está a equação de tal reação com o propeno como exemplo:
4O2 + C3H4 = 2H2O + 3 CO 2
A combustão de outros hidrocarbonetos de acetileno também ocorre de forma semelhante. Como resultado, liberam-se água e dióxido de carbono.
Outras reações
Também os acetilenos são capazes de reagir com sais de metais tais como prata, cobre, cálcio. Ao mesmo tempo, os átomos de hidrogênio são substituídos por átomos de metal. Considere este tipo de reação no exemplo com acetileno e nitrato de prata:
C 2 H 2 + 2 AgNO 3 = Ag 2 C 2 + 2 NH 4 NO 3 + 2H 2 O
Outro processo interessante envolvendo alkinos é a reação de Zelinsky. Esta é a formação de benzeno a partir de acetileno quando é aquecida a 600 graus Celsius na presença de carbono ativado. A equação desta reação pode ser expressa assim:
3C2H2 = C6H6
Também é possível a polimerização de alquinos – o processo de combinação de várias moléculas de matéria em um único polímero. 
Recebendo
Alkines, as reações com as quais discutimos acima, são obtidas em laboratório por vários métodos.
O primeiro é a desidro-halogenação. A equação da reação parece assim:
C 2 H 4 Br 2 + 2 KOH = C 2 H 2 + 2 H 2 O + 2KBr
Para realizar esse processo, é necessário aquecer os reagentes e também adicionar o etanol como catalisador.
Também é possível obter alquinas a partir de compostos inorgânicos. Aqui está um exemplo:
CaC2 + H2O = C2H2 + 2 Ca (OH) 2
O próximo método de obtenção de alquinos é a desidrogenação. Aqui está um exemplo de tal reação:
2CH4 = 3H2 + C2H2
Com a ajuda deste tipo de reação, é possível obter não só a etina, mas também outros hidrocarbonetos de acetileno.

O uso de alquimatos
O mais comum na indústria foi o alkyne-ethyne mais simples. É amplamente utilizado na indústria química.
- Você precisa de acetileno e outros alquinos para obtê-los de outros compostos orgânicos, como cetonas, aldeídos, solventes, etc.
- Também de alkynes é possível obter substâncias que são utilizadas na produção de borrachas, cloreto de polivinilo, etc.
- Do propinum é possível receber acetona como resultado do relatório de Kucherov.
- Além disso, o acetileno é utilizado na preparação de produtos químicos, tais como ácido acético, hidrocarbonetos aromáticos, álcool etílico.
- Outro acetileno é usado como combustível com um calor muito alto de combustão.
- Além disso, a reação de combustão do etano é usada para soldar metais.
- Além disso, com o uso de acetileno, pode-se obter um carbono técnico.
- Também esta substância é usada em luminárias autônomas.
- O acetileno e uma série de outros hidrocarbonetos deste grupo são utilizados como combustível por foguete devido ao seu alto calor de combustão.
Este é o fim do uso de alkynes. 
Conclusão
Como parte final, damos uma breve tabela sobre as propriedades dos hidrocarbonetos acetilénicos e sua produção.
| Nome da reação | Explicações | Um exemplo de equação |
| Halogenação | A reacção da adição de átomos de halogéneo (brometo, iodo, cloro, etc.) à molécula de hidrocarboneto de acetileno | C 4 H 6 + 2 I 2 = C 4 H 6 I 2 |
| Hidrogenação | A reação da ligação de átomos de alcino a átomos de hidrogênio. Isso ocorre em duas etapas. |
C 3 H 4 + H 2 = C 3 H 6 C 3 H 6 + H 2 = C 3 H 8 |
| Hidrohalogenação | A reação da adição de hidro-halogênio (HI, HCl, HBr) por uma molécula de hidrocarboneto de acetileno. Isso ocorre em duas etapas. |
C 2 H 2 + HI = C 2 H 3 I C 2 H 3 I + HI = C 2 H 4 I 2 |
| Hidratação | Uma reação baseada na interação com a água. Isso ocorre em duas etapas. |
C 2 H 2 + H 2 O = C 2 H 3 OH C 2 H 3 OH = CH 3 -CHO |
| Oxidação completa (combustão) | Interação de hidrocarboneto de acetileno com oxigênio a temperatura elevada. Como resultado, o monóxido de carbono e a água são formados. |
2C2H5 + 5O2 = 2H2O + 4CO2 2C 2 H 2 + 2 O 2 = H 2 O + CO 2 + 3 C |
| Reações com sais metálicos | A conclusão é que os átomos de metal substituem os átomos de hidrogênio nas moléculas de hidrocarbonetos de acetileno. |
C 2 H 2 + AgNO 3 = C 2 Ag 2 + 2 NH 4 NO 3 + 2H 2 O |
Alkines podem ser obtidos em condições de laboratório de três maneiras:
- De compostos inorgânicos;
- Por desidrogenação de substâncias orgânicas;
- Método de desidro halogenação de substâncias orgânicas.
Então examinamos todas as características físicas e químicas dos alquinos, os métodos de produção, o campo de aplicação na indústria.















