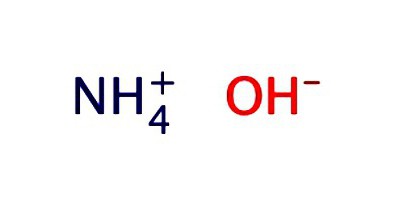
Fórmula amoníaco. hidróxido de amónio – amoníaco aquoso
nitreto de hidrogénio – – Amoníaco uma das mais importantes compostos de azoto e hidrogénio. Este gás sem cor, mas com um odor pungente. A composição química reflecte amoníaco fórmula – NH 3. O aumento da pressão ou de diminuição da temperatura do material leva a sua cada vez de um líquido incolor. gás de amônia e suas soluções são amplamente utilizados na indústria e na agricultura. O medicamento é utilizado 10% de hidróxido de amónio – amoníaco.
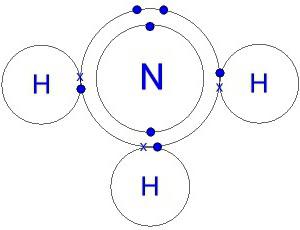
A estrutura da molécula. fórmula amoníaco electrónico
Uma molécula de nitreto de hidrogénio tem a forma de uma pirâmide, cuja base é azoto ligado a três átomos de hidrogénio. N-H ligação é fortemente polarizada. Azoto é fortemente atraída par de electrões de ligação. Por conseguinte, uma carga negativa se acumula sobre os átomos de N, o – positivos focados em hidrogénio. A compreensão do presente processo fornece um modelo da molécula, a electrónica e a fórmula estrutural de amoníaco.
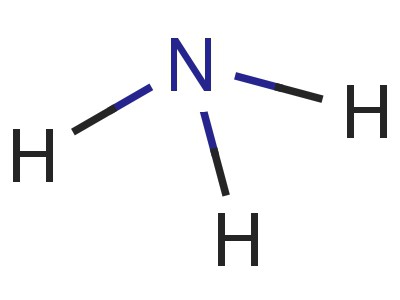
hidrogénio nitreto é muito solúvel em água (700: 1 a 20 ° C). Tendo protões substancialmente livres leva à formação de múltiplas "pontes" de hidrogénio que se conectam entre uma molécula. Características de ligação a estrutura química e também levam para o facto de que a amónia é facilmente liquefeito através do aumento da pressão ou de abaixamento da temperatura (-33 ° C).

Origem do nome
O termo "de amoníaco" foi introduzido para a comunidade acadêmica em 1801, por sugestão do químico russo Ya Zakharova, mas substância familiar para a humanidade desde os tempos antigos. Gás com um odor pungente libertado durante o decaimento de resíduos de produtos de diversos compostos orgânicos, por exemplo, proteínas e ureia na decomposição de sais de amónio. Os historiadores da química acreditam que a substância foi nomeado após o antigo deus egípcio Amon. Siwa (Ammon) é um oásis no norte da África. Cercado por deserto líbio as ruínas da antiga cidade e do templo, junto ao qual há depósitos de cloreto de amônio. Esta substância na Europa, chamado de "sal de Amom." É preservada a tradição de que os habitantes do oásis de Siwa cheiro de sal no templo.
nitreto de hidrogénio
Inglês químico e físico R. Boyle em experiências queimado estrume e observou-se a formação de fumo branco da zaragatoa mergulhada em ácido clorídrico e o resultante introduzido no jacto de gás. Em 1774, um outro químico britânico J. Priestley aquecida cloreto de amónio com cal apagada e gasoso alocado. Priestley denominado composto "ar alcalina", porque as suas propriedades da solução mostrou uma base fraca. Recebida explicação experiência Boyle, em que faz-se reagir amoníaco com ácido clorídrico. Sólido de cloreto de amónio branco ocorre após o contacto das moléculas de reagentes no ar.
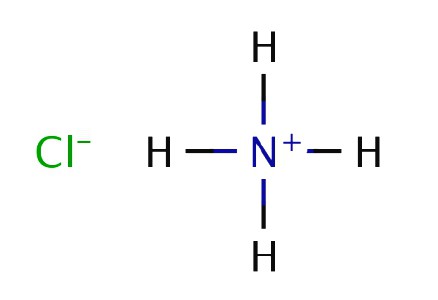
fórmula química de amoníaco foi fixada em 1875 K. Berthollet por francês que realizou uma experiência sobre a decomposição de substâncias nos seus componentes constituintes pela descarga eléctrica. Até agora, as experiências Priestley, Boyle Bertholet e reproduzir em laboratório para produzir nitreto de hidrogénio e cloreto de amónio. método industrial desenvolvido em 1901 por H. Le Chatelier, recebeu uma patente para um método de síntese de uma substância de azoto e hidrogénio.
Uma solução de amoníaco. Fórmula e propriedades
A solução aquosa de amoníaco é normalmente gravada na forma de hidróxido de – NH 4 OH. Ele apresenta as propriedades de um alcalino fraco:
- dissocia-se em iões de NH 3 + H 2 O = NH 4 OH = NH4 + + OH -;
- solução de fenolftaleína cora o carmesim;
- é feito reagir com um ácido para formar um sal e de água;
- precipita Cu (OH) 2 como uma substância azul brilhante quando misturados com sais de cobre solúveis.
O equilíbrio da reacção de amoníaco com água interacção é deslocado para os materiais de partida. nitreto de hidrogénio pré-aquecido queima bem em oxigénio. Ela ocorre oxidação de azoto ao moléculas diatómicas substância simples N2. A redução também exibe propriedades amoníaco na reacção com o óxido de cobre (II).

Significado de amônia e soluções
Nitreto de hidrogénio usado na produção de sais de amónio e de ácido nítrico – um dos principais produtos da indústria química. Amoníaco é a matéria-prima para o refrigerante (como método de nitrato). Hidrogénio teor de nitreto industrialmente solução concentrada atinge 25%. Na agricultura, usam amoníaco aquoso. fertilizante líquido fórmula – NH 4 OH. A substância é utilizada directamente como uma cobertura. Outros métodos de solo azoto enriquecimento – o uso de sais de nitratos de amónio, cloretos, fosfatos. Em ambientes industriais e zonas agrícolas não é recomendado para armazenar juntos adubos que contêm sais de amónio com álcalis. Quando o material de embalagem ruptura pode reagir com cada outro para formar amónia e lançá-lo para os espaços de ar. composto tóxico afecta adversamente o sistema respiratório, do sistema nervoso central. A mistura de amoníaco com o ar, é explosivo.












