ligação metálica: o mecanismo de formação. Metal Chemical Communication:
Todos os elementos químicos actualmente conhecidas na tabela periódica são divididos arbitrariamente em dois grupos: os metais e não-metais. Para se tornar não só elementos e compostos, produtos químicos podem reagir uns com os outros, eles devem existir na forma de compostos simples e complexos.
É por isso que alguns elétrons estão tentando adotar, e os outros – para dar. Reabastecer um ao outro de modo a formar vários elementos e moléculas químicas. Mas o que lhes permite ser realizada em conjunto? Por que há tal questão de força, para destruir que transcende até mesmo os instrumentos mais graves? E outros, por outro lado, são destruídos pelo menor impacto. Tudo isto é devido à formação de vários tipos de ligações químicas entre os átomos nas moléculas que formam a estrutura específica da rede cristalina.
Tipos de ligações químicas em compostos
Total pode distinguir quatro tipos principais de ligações químicas.
- nonpolar covalente. Formado entre dois não-metais idênticos devido à partilha de electrões, que formam pares de electrões comuns. Na educação, ele é atendido partículas valência desemparelhados. Exemplos: halogéneos, oxigénio, hidrogénio, azoto, enxofre, fósforo.
- covalente polar. Formada entre dois elementos não-metálicos ou diferentes entre muito fraco nas propriedades do metal e metalóide fraco em electronegatividade. pares de elétrons subjacentes e gerais e puxando-os para ela do átomo, cuja afinidade acima de elétrons. Exemplos: NH 3, SiC, P 2 O 5 e outro.
- ligação de hidrogénio. O mais instável e fraco, é formada entre o átomo altamente electronegativo de uma molécula e a outra positiva. Isto ocorre mais frequentemente quando dissolvido substâncias em água (álcool, amoníaco e assim por diante). Devido a uma tal ligação pode existir proteínas macromoleculares, ácidos nucleicos, hidratos de carbono complexos, e assim por diante.
- ligação iónica. Formou-se devido a forças atractivas iões metálicos raznozaryazhennyh electrostáticas e não-metais. Quanto maior for a diferença neste índice, mais pronunciada é a natureza iónica da interacção. Exemplos de compostos: sal binário, composto complexo – alcalino.
- ligação metálica, que o mecanismo de formação e as propriedades que serão discutidas mais adiante. Formada em metais, ligas deles de vários tipos.
Há uma coisa como a unidade da ligação química. Ele apenas diz que é impossível considerar cada benchmark de títulos. Eles são apenas o símbolo da unidade. Afinal de contas, a base de todas as interações é um único princípio – elektronnostaticheskoe interação. Portanto, iónico, metálico, ligação covalente e o hidrogénio tem um único natureza química e são apenas casos limite para o outro.
Metais e as suas propriedades físicas
Os metais são encontrados na grande maioria de todos os elementos químicos. Isto é devido às suas propriedades especiais. Uma parte significativa da qual foi obtido por uma pessoa por meio de reacções nucleares no laboratório, eles são radioactivos com uma meia-vida curta.
No entanto, a maioria – são elementos naturais que formam as rochas integrais e minérios, fazem parte dos compostos mais importantes. É por causa dessas pessoas aprenderam a lançar ligas e produzir uma grande quantidade de produtos excelentes e importantes. Isto é, tais como cobre, ferro, alumínio, prata, ouro, crómio, manganês, níquel, zinco, chumbo e outros.
Para todos os metais podem identificar propriedades físicas comuns que explica a formação da ligação metálico diagrama. Quais são essas características?
- Maleabilidade e ductilidade. Sabe-se que muitos metais podem ser rolados para baixo até ao ponto de folha (ouro, alumínio). De outro receber um arame, de metal folhas flexíveis, capazes artigos deformados por impacto físico, mas, em seguida, recuperar a partir da sua terminação. Estas são as qualidades de metais e é chamado de maleabilidade e ductilidade. A razão para esta função – um tipo de link metal. Os iões e os electrões no cristal deslizante relativamente uns aos outros sem quebrar, o que permite preservar a integridade de toda a estrutura.
- brilho metálico. Isso também explica a ligação metálica, o mecanismo de formação de suas características e funcionalidades. Assim, nem todas as partículas são capazes de absorver ou reflectir ondas de luz de comprimento igual. Átomos a maioria dos metais e reflectir de onda curta raios tornar-se substancialmente uniforme de cor prateada, branco, pálido matiz azulada. As exceções são o cobre eo ouro, sua cor é amarelo-avermelhado e vermelho, respectivamente. Eles são capazes de refletir a radiação de longo comprimento de onda.
- Térmica e condutividade elétrica. Estas propriedades também explicar a estrutura cristalina e em que a sua formação é realizada ligações de tipo metálico. Devido à "gás de electrões" movendo-se dentro do cristal, corrente eléctrica e o calor rapidamente e uniformemente distribuído entre todos os átomos e iões e conduzido através do metal.
- O estado agregado sólido sob condições normais. Aqui, a única exceção é o mercúrio. Todos os outros metais – é, conexões sólidas necessariamente fortes, bem como as suas ligas. Também é o resultado do facto de que, na presença de ligação de metal de metal. O mecanismo de formação deste tipo de propriedades de ligação de partículas totalmente confirmada.
Esta características físicas de base para metais, o que explica e determina a formação de ligação metálica exactamente diagrama. compostos relevantes tal método consiste em átomos de metais de elementos, as suas ligas. Isso é para eles um sólido e um estado líquido.

tipo metálico de ligação química
Qual é a sua característica? A questão é que essa relação não é formado por iões raznozaryazhennyh e atracção electrostática e não devido à diferença de electronegatividade e a disponibilidade de pares de electrões livres. iónico, metálico, ou seja, ligação covalente tem várias natureza diferente e características distintivas de partículas que ligam.
Todos os metais são características inerentes, tais como:
- uma pequena quantidade de electrões no nível de energia exterior (excepto algumas excepções, para o qual não pode ser 6,7 e 8);
- grande raio atômica;
- baixa energia de ionização.
Tudo isso contribui para uma fácil separação dos elétrons desemparelhados no núcleo externo. Neste caso, os orbitais livres do átomo permanece muito. Esquema da ligação metálica apenas irá mostrar várias células sobrepostas de diferentes átomos de orbitais entre si, o que resulta na intracristalino e formar um espaço comum. Ele serve electrões de cada átomo que começam livremente vaguear em diferentes partes da estrutura. Periodicamente, cada um dos quais está ligado a um ião na unidade de cristal e converte-lo a um átomo, em seguida, separado mais uma vez, formando iões.
Assim, a ligação metálica – é a ligação entre os átomos, iões e electrões livres no cristal de metal total. A nuvem de electrões, mover-se livremente no interior da estrutura, designada por "gás de electrões". Foi explicado a eles, a maioria das propriedades físicas de metais e suas ligas.
Como especificamente implementa uma ligação química metálico? Exemplos são diferentes. Vamos considerar um pedaço de lítio. Mesmo se você levá-la ao tamanho de uma ervilha, existem milhares de átomos. Por isso, vamos imaginar que cada um desses milhares de átomos dá um elétron de valência em um único espaço cristalina comum. Ao mesmo tempo, conhecer a estrutura eletrônica do elemento, você pode ver o número de orbitais vagos. Na sua lítio é 3 (o segundo nível de energia orbital p). Três cada átomo de dezenas de milhares – este é um espaço comum dentro do cristal, em que o "gás electrónico" move-se livremente.

Substância sempre ligação metálica forte. Afinal, o gás de elétrons não permite que o cristal cair, mas apenas muda as camadas e, em seguida, recupera. Ela brilha têm uma certa densidade (geralmente alta), a fusibilidade, a maleabilidade e ductilidade.
Onde mais percebeu ligação metálica? Exemplos de substâncias:
- metais como estruturas simples;
- todas as ligas de metais uns com os outros;
- todos os metais e suas ligas em estado líquido e sólido.
Exemplos específicos são simplesmente uma quantidade incrível, porque o metal na tabela periódica, mais de 80!
ligação metálica: o mecanismo de formação
Se considerarmos que, em termos gerais, os principais pontos que temos descrito acima. Disponibilidade de orbitais atômicos e elétrons facilmente retirado do núcleo por causa da baixa energia de ionização – são as principais condições para a formação deste tipo de comunicação. Assim, verifica-se que é aplicada entre as seguintes partículas:
- átomos na rede cristalina;
- electrões livres, que estavam na valência do metal;
- os iões na rede cristalina.
O resultado – uma ligação metálica. O mecanismo de formação geralmente expressa pela seguinte entrada: 0 Me – e – ↔ Me n +. A partir do diagrama, evidentemente, quaisquer partículas de metal estão presentes no cristal.
Cristais si podem ter formas diferentes. Depende do material com o qual estamos lidando.
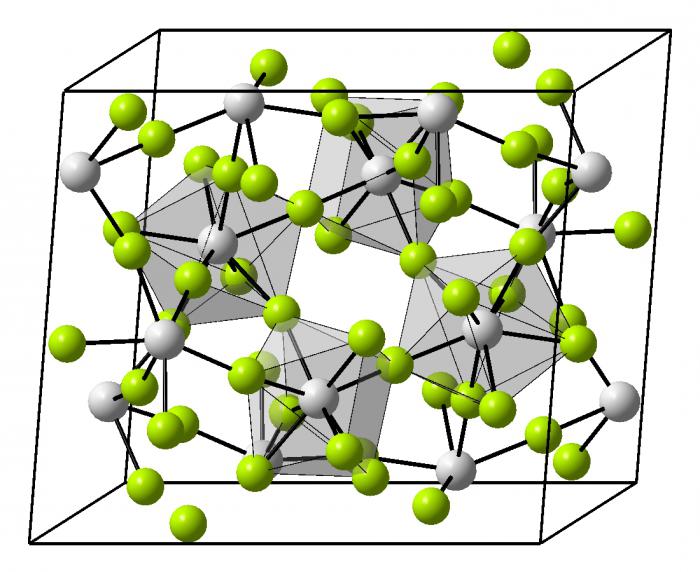
Tipos de cristais metálicos
Esta estrutura do metal ou da sua liga tem um empacotamento muito denso de partículas. Ele fornece iões nos sítios de cristal. Por si só, a rede pode ser de diferentes formas geométricas no espaço.
- Obemnotsentricheskaya rede cúbica – metais alcalinos.
- estrutura hexagonal compacta – tudo alcalina, com exceção de bário.
- Granetsentricheskaya cúbico – alumínio, cobre, zinco, muitos metais de transição.
- estrutura romboédrica – o mercúrio.
- Tetragonal – índio.
Os metais pesados e quanto menor ele está localizado no sistema periódico, o mais difícil é embalagem e organização espacial do cristal. Quando esta ligação química do aço, exemplos dos quais podem ser reduzidas para cada metal existente é decisiva na construção do cristal. Ligas têm uma organização muito diversificada no espaço, alguns deles ainda não são totalmente compreendidos.

Especificações de comunicação: nondirectionality
ligação covalente e metal tem uma característica distintiva muito pronunciado. Ao contrário da primeira, a ligação metálica não é dirigida. O que significa? Ou seja, a nuvem de elétrons dentro do cristal move-se livremente dentro dela em direções diferentes, cada um elétron é capaz de juntar-se absolutamente qualquer íon na estrutura de nós. Ou seja, a interação é realizada em direções diferentes. Assim, eles dizem que a ligação metálica – não-direcional.
O mecanismo de ligação covalente envolve a formação de pares de electrões partilhados, isto é, nuvens de átomos de sobreposição. E ocorre estritamente em uma determinada linha conectando seus centros. Portanto, falando sobre o sentido de tal conexão.
saturabilidade
Esta característica reflecte a capacidade dos átomos para uma interacção limitada ou ilimitada com os outros. Por exemplo, covalente e ligação de metal sobre este indicador de novo são opostos.
O primeiro está cheio. Átomos envolvidos na sua formação são um número fixo de electrões de valência externas directamente envolvidas na formação do composto. Mais do que comer, não serão os elétrons. Portanto, o número de ligações de valência formada limitada. Daí saturação devido. Devido a esta característica da maior parte dos compostos que tem uma composição química constante.
Metais e ligações de hidrogênio, por outro lado, não saturação. Isto é devido a muitos elétrons livres e orbitais dentro do cristal. O papel desempenhado pelos iões nos sítios da rede de cristal, cada um dos quais pode ser um átomo e um ião de novo em qualquer momento.

Outra característica da ligação metálica – deslocalização nuvem de electrões interno. Ela se manifesta na capacidade de uma pequena quantidade de elétrons compartilhado ligar a pluralidade de metais de núcleos atômicos. Isto é, a densidade de deslocalizada, uma vez que é distribuído igualmente entre todas as unidades do cristal.
Exemplos de formação de uma ligação em metais
Considere algumas formas de realização específicas, que ilustram, como uma ligação metálica é formada. Exemplos Os seguintes substâncias:
- zinco;
- alumínio;
- potássio;
- cromado.
formação da ligação metálica entre átomos de zinco: Zn 0 – 2e – ↔ Zn 2+. átomo de zinco tem quatro níveis de energia. orbitais livres com base na estrutura electrónica, que tem 15 – 3 orbitais p, 4 d 5 e 7 em 4f. estrutura electrónica incluem: 1s 2s 2 2 2 6 2p 3s 3p 6 4s 2 3d 10 4d 4p 0 0 0 4-F, apenas 30 electrões do átomo. Ou seja, duas partículas negativas valência livre é capaz de mover-se dentro dos 15 orbitais espaçosos e ninguém ocupada. E assim cada átomo. O resultado – um espaço total enorme consistindo de orbitais vazias, e uma pequena quantidade de electrões que ligam toda a estrutura em conjunto.
A ligação metálica entre os átomos de alumínio: AL 0 – e – ↔ Al3 +. Treze átomos de electrões de alumínio situadas em três níveis de energia, que são claramente falta em abundância. estrutura eletrônica: 1s 2s 2 2 2p 6 3s 3p 1 2 0 3d. orbitais gratuitos – 7 peças. Obviamente, a nuvem de electrões será pequeno em comparação com o espaço livre interna total no cristal.

O crómio ligação metálica. Este elemento particular da sua estrutura electrónica. Depois de tudo, para a estabilização da falha do sistema ocorre com 4s electrões a 3d orbital: 1s 2s 2 2p 2 6 2 3s 4s 3p 6 1 5 4p 3d 4d 0 0 0 4-F. Apenas 24 valência de electrões dos quais são seis. Eles vão para o espaço eletrônico comum sobre a formação de uma ligação química. orbitais livre 15, que ainda é muito maior do que o necessário para preencher. Portanto, crómio – como um exemplo típico de um metal com uma ligao correspondente na molécula.
Um dos metais mais activos que reagem mesmo com água comum ao fogo, é o potássio. O que explica essas propriedades? Mais uma vez, em muitos aspectos – tipo metálico de bond. Elétrons no elemento de apenas 19 anos, mas eles estão localizados tanto quanto 4 níveis de energia. Que é de 30 diferentes subníveis orbitais. estrutura eletrônica: 1s 2s 2 2p 2 6 2 3s 4s 3p 6 1 0 4p 3d 4d 0 0 0 4-F. Apenas dois elétrons de valência com energia muito baixa ionização. Livre para sair e ir para o espaço eletrônico comum. Orbitais de deslocação de um átomo de peças 22, isto é, um espaço muito grande para o "gás de electrões".
Semelhanças e diferenças com outros tipos de títulos
Em geral, a questão já foi discutida acima. Só se pode generalizar e tirar uma conclusão. A principal característica de todos os outros tipos de recursos de comunicação é o metal cristais são:
- vários tipos de partículas que participam no processo de ligação (átomos, iões ou átomos, iões, electrões);
- estrutura geométrica espacial diferente de cristais.
Com hidrogénio e de metal iónico combina saciedade e não-dirigido. Com covalente polar – forte atracção electrostática entre partículas. Separadamente, ião – Tipo de partículas nos pontos da rede cristalina (iões). Com apolar covalente – átomos nos sítios de cristal.
Tipos de ligações em metais de estado de agregação diferente
Como já mencionado acima, ligação química metálico, exemplos dos quais são dados no artigo, é formada em dois estados de agregação de metais e suas ligas: sólido e líquido.
A questão é: que tipo de ligação com o vapor de metal? A: covalente polar e não polar. Tal como acontece com todos os compostos presentes em um gás. Que não é rasgada e a estrutura cristalina é mantida durante o aquecimento prolongado do metal e transferi-lo do sólido para comunicação de líquido. No entanto, quando se trata de transferência de líquido para o estado de vapor, o cristal é destruída e ligação metálica é convertido para covalente.















