A massa molar de oxigénio. Qual é a massa molar de oxigênio?
Átomos de elementos e compostos de moléculas exibem massa negligenciável. Para estudar as relações quantitativas, específicas para reacções químicas, utilizando várias quantidades físicas. Um deles – a massa molar, que pode ser calculada para os átomos, iões e moléculas. Um dos elementos mais importantes na Terra – oxigênio, com a sua participação ocorrer, muitas reações e processos. Para realizar os cálculos de acordo com as fórmulas dos compostos utilizados equações de reacção massa molar de oxigénio, que é numericamente igual ao seu peso relativo de um átomo ou molécula.
oxigênio
Informações gerais sobre o oxigênio (elemento químico)
- nome latino – Oxygenium;
- símbolo químico – O;
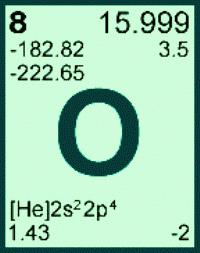
- armazenada na porção superior 16 do primeiro grupo (anteriormente – grupo VI A) da tabela periódica;
- É localizado no segundo período imediatamente após azoto antes de flúor;
- Ele refere-se a um calcogeno família;
- número de elementos da tabela periódica e a sua carga de núcleos de átomos de – 8.
O oxigénio é um dos componentes da atmosfera por um longo tempo não pode ser isolado em forma pura. Gas chamado de "dar vida", "o elixir da vida." Comemore a abertura do oxigénio é dividido entre os cientistas conhecido do mundo: K. Scheele, J. Priestley, Antoine Lavoisier .. O termo "Oxygen" Lavoisier proposto, baseado sobre o papel importante da substância, seus átomos na formação de óxidos e ácidos.

Como encontrar a massa molar de um elemento ou substância?
Ao realizar cálculos químicos necessário conhecer a massa envolvida nas reacções de átomos e as moléculas de substâncias. Mas eles são muito pequenos, o que dificulta a utilização de tais unidades, como gramas e quilogramas. A solução foi encontrado: oferecido outros valores que facilitam os cálculos. Por exemplo, na química valores são massa atómica e molecular relativa. A massa atômica relativa (Ar) como a quantidade física foi introduzido no ano de 1961. O seu valor é igual a 1/12 da massa de um átomo de carbono (o isótopo 12 C).
Para executar cálculos usando fórmulas e equações com o uso deste e de outros valores precisam lembrar de algumas regras:
- átomo de massa no sistema periódico contém ao lado sinal químico. A massa molar tem o mesmo valor numérico, mas com as unidades de g / mol.
- Peso de uma mole da substância é determinado a partir da fórmula do composto são para que a soma da massa molar de todas as partículas na molécula.
- Se a fórmula química é um índice que indica o número de unidades estruturais, é necessário multiplicar a massa molar deste coeficiente.
peso atómica e molecular do oxigénio
A massa atómica de oxigénio é obtido com base no número e distribuição de três dos seus isótopos naturais: Ar (L) = 15.999 (em um e m …). Nos cálculos, esse valor é geralmente arredondado, se transforma 16. Para cada elemento do seu peso atômico – constante. A partir do peso conhecido de átomos do elemento de número atómico 8 pode ser encontrado pela massa molar do elemento de oxigénio. H (S) = 16. Outra quantidade física adimensional – o peso molecular de oxigénio – refere-se a uma substância simples. Calcular a massa da molécula de oxigénio, multiplicando-se o peso de um átomo no coeficiente estequiométrico na fórmula: Sr (O 2) = Ar (L). 2 = 16. 2 = 32. Na prática, não há necessidade de descobrir o que a massa molar de oxigénio, porque o seu valor é numericamente igual ao peso das moléculas da substância mas com a unidade de medida de g / mole. Para um composto particular é o seu peso molecular é constante, é amplamente utilizado para calcular a quantidade e a massa da substância.

quantidade de substância
Em química, por conveniência de cálculos, ele usa uma das grandezas físicas mais importantes – a quantidade de substância. Não se refere ao peso, e para o número de unidades estruturais. A unidade de medição da quantidade de substância no Internacional Sistema (SI) recebeu 1 mol. Sabendo-se que 1 mol inclui mesmas partículas que estão contidos em 12 g de carbono isótopo 12 C pode ser calculado o número de átomos, moléculas, iões, electrões contidas na porção de teste de qualquer substância. Outra constante foi o nome do grande cientista italiano Avogadro (denotado N A), Ela é o número de partículas estruturais que contém uma quantidade de substância se – 1 mol. O valor numérico da constante de Avogadro – 6,02. 23 de outubro de 1 / mol. É o número de átomos (moléculas, iões) tem uma massa molar. Designação da quantidade física – H unidade – 1 g / mol, para a fórmula de cálculo – M = m / n (m – peso (g), N – quantidade de substância (molar)).
Qual é a massa molar de oxigênio
Na prática, não há necessidade de usar a fórmula M = m / n para calcular a massa molar de oxigénio. Na resolução de problemas é necessária para determinar a mais, o que é a massa, ou para encontrar um número de substâncias. No primeiro caso é utilizada para a fórmula de cálculo m = n. H, no segundo – n = m / M. O valor numérico da massa molar igual ao átomo de elemento de massa, e para a substância – molécula. Por exemplo, a massa de 16 g é de 1 mole de elemento de oxigénio. H (O 2) – a massa molar da molécula de oxigénio, o que é igual a 32 g / mole.
A massa molar equivalente de oxigénio
Chamado equivalente igual quantidade de peso de 1 mol de átomos monovalentes de qualquer elemento. Em geral, o peso equivalente pode ser determinada dividindo-se a massa molar de átomos do elemento químico a sua valência, encontrado pela fórmula do composto particular. Na maior parte dos seus compostos oxigenados como químico-elemento calcogeno é divalente. massa molar de oxigénio podem ser encontrados na tabela periódica, o seu valor arredondado – 16. O peso equivalente de menos do que 2 vezes – 8 química aplicáveis equivalentes direito, que afirma que as substâncias são feitos reagir em conjunto em quantidades iguais para os seus equivalentes. Quando executar cálculos pode usar a massa molar equivalente de oxigénio para determinar o peso equivalente da substância para o qual é desconhecido.

Oxigênio – um dos elementos mais importantes na crosta terrestre, sendo responsável por 46,6% da massa. Uma simples conexão com o mesmo nome – o segundo mais comum na atmosfera da Terra. O teor de oxigénio molecular no ar – 20,947% em volume. Com o auxílio de átomos e moléculas membro ocorrer muitas reacções e processos na arte, a indústria, a natureza orgânica e inorgânica. É importante ter em conta as relações quantitativas nestes processos, o que facilita muito o uso de quantidades físicas, incluindo a massa molar de oxigênio.

















