compostos de enxofre. O grau de oxidação do enxofre nos compostos. compostos de enxofre de fórmula
calcogeno subgrupo inclui enxofre, – um segundo elemento que é capaz de formar um grande número de depósitos de minério. Sulfatos, sulfuretos, óxidos de outros compostos de enxofre são muito difundida, e importante natureza industrial. Portanto, neste artigo, vamos olhar para o que são, que representa um enxofre em si, é uma questão simples.

De enxofre e a sua caracterização
Este elemento tem a seguinte posição no sistema periódico.
- O sexto grupo, o grupo principal.
- Um terceiro pequeno período.
- massa atômica – 32,064.
- Número de série – 16, protões e electrões, bem como 16 neutrões.
- Ele refere-se aos elementos, não-metais.
- Nas fórmulas lido como "es", o nome do elemento enxofre, enxofre Latina.
Na natureza, há quatro isótopos estáveis com números de massa 32,33,34 e 36. Este elemento do sexto mais comuns na natureza. Ele refere-se aos elementos biogénicos, como uma parte de moléculas orgânicas importantes.
A estrutura electrónica do átomo
Os compostos de enxofre são, devido a uma variedade de características da estrutura electrónica do átomo. Ela é expressa pela seguinte configuração fórmula: 1s 2s 2 2 2 6 2p 3s 3p 4.
A ordem acima reflete um estado de equilíbrio do elemento. Mas sabemos que se o átomo para fornecer energia adicional, é possível emparelhar elétrons de quebra 3p e 3s-subcamada, seguido por outra transição para o 3D, que permanece livre. Como resultado, não só muda a valência do átomo, mas também todos os possíveis estados de oxidação. O seu número é significativamente aumentada, bem como o número de diferentes substâncias com enxofre.
O grau de oxidação do enxofre nos compostos
Existem várias opções básicas deste indicador. O enxofre é:
- -2;
- +2;
- 4;
- 6.
Destes, o S mais rara +2, o resto são espalhados por toda parte. O grau de oxidação dos compostos de enxofre na reactividade dependente e poder de oxidação de todas as substâncias. Por exemplo, os compostos com -2 – lo sulfuretos. Eles consideraram-nos um elemento típico do agente oxidante.
Quanto maior o grau de oxidação no composto, o mais pronunciado terá oxidante substância capacidade. Isso é facilmente visto se lembrarmos os dois ácidos básicos que formam enxofre:
- H 2 SO 3 – sulfuroso;
- H 2 SO 4 – ácido sulfúrico.
Sabe-se que o último é muito mais estável, composto resistente tendo uma elevada concentração de capacidade muito sério para oxidar.
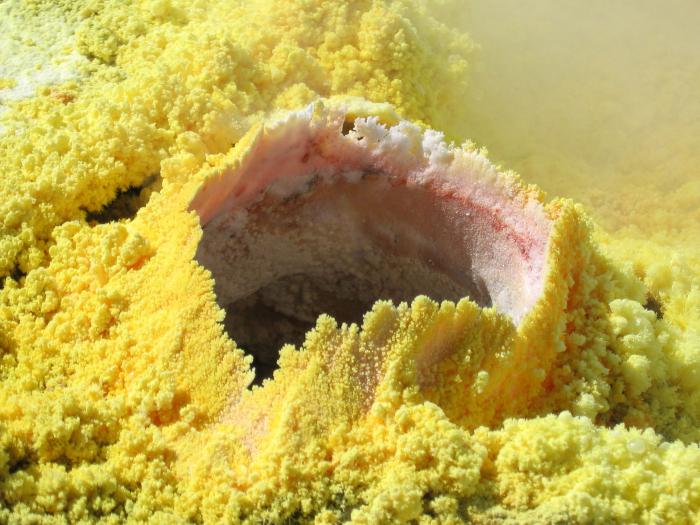
substância simples
Como simples enxofre substância é um amarelo bonitos cristais alongados plano correcto. Embora esta é apenas uma das suas formas, porque há dois principais modificações alotrópicas desta substância. Em primeiro lugar, monoclica ou ortorrbica – este é um amarelo substância cristalina, não solúvel em água, mas apenas em solventes orgânicos. fragilidade caracterizado e estrutura de forma bonita representada na forma de uma coroa. Ponto de fusão – cerca de 110 0 C.
Se você não pular o ponto intermediário pelo aquecimento de uma tal modificação, é possível detectar oportuna outro estado – enxofre plástico. Ele é uma solução castanho viscoso semelhante a borracha, o qual após um aquecimento adicional ou têmpera novamente passa para a forma rômbica.
Se falamos de enxofre quimicamente puro, obtido por múltiplos filtrações, é uma forma de cristais amarelos brilhantes pequenas, frágeis e completamente insolúveis em água. inflame capaz em contacto com a humidade e oxigénio atmosférico. Differ actividade química suficientemente alta.

Estar na natureza
Na natureza, há depósito natural a partir de compostos de enxofre que são extraídos-se como uma substância simples. Além disso, ela contém:
- em minerais, minérios e rochas;
- em animais, plantas e seres humanos, como uma parte de muitas moléculas orgânicas;
- em gases naturais, o petróleo e o carvão;
- em óleo de xisto e águas naturais.
Você pode citar alguns dos minerais de enxofre mais ricos:
- cinábrio;
- pirita;
- sphalerite;
- stibnite;
- galena e outros.
A maior parte do enxofre produzido hoje vai para a produção de sulfato. Outra parte é usada para fins medicinais, agricultura, processos de fabricação de produtos químicos industriais.
Propriedades físicas
Eles podem descrever em poucos parágrafos.
- A água é insolúvel em dissulfureto de carbono, terebintina, ou – bem dissolvida.
- fricção prolongada acumula carga negativa.
- Ponto de fusão de 110 0 C.
- O ponto de ebulição de 190 0 C.
- Ao atingir a 300 0 C passa no líquido de escoamento.
- A substância pura é capaz de auto-ignição propriedades inflamáveis são muito bons.
- Por si só não tem quase nenhum cheiro, mas os compostos de enxofre de hidrogénio emitem um cheiro pungente de ovos podres. Bem como alguns representantes do binário gasoso.
As propriedades físicas da substância em questão foi conhecido para as pessoas desde os tempos antigos. É por sua combustibilidade de enxofre e tem o seu nome. Nas guerras utilizados asfixiantes e gases venenosos que são gerados durante a combustão do composto, como uma arma contra os inimigos. Além disso, o ácido com enxofre também sempre teve importância industrial.

Propriedades químicas
Assunto: "Enxofre e seus compostos" não tirar uma lição no curso de química da escola, mas vários. Afinal, um monte deles. Isto é devido à actividade química da substância. Pode ser ambas as propriedades oxidantes com uma forte agentes redutores (metais, de boro, etc), e a recuperação da maioria dos não metais.
No entanto, apesar de tal actividade apenas com interacção flúor prossegue sob condições habituais. Para todos os outros, você quer para aquecer. várias categorias de materiais pode ser designada, que é capaz de reagir com o enxofre:
- metais;
- não-metais;
- álcalis;
- ácido forte oxidante – sulfúrico, e ácido nítrico.
compostos de enxofre: espécies
Variedade seu valor irá ser explicado por diferentes graus de membro de base de oxidação – enxofre. Assim, alguns tipos básicos de substâncias podem ser identificados com base em:
- composto com oxidação -2;
- 4;
- 6.
Se considerarmos as classes, e não um indicador de valências, esse elemento formas, tais como moléculas:
- ácido;
- óxidos;
- compostos de enxofre de hidrogénio;
- sal;
- compostos binários com elementos não-metálicos (dissulfureto de carbono, cloretos);
- substâncias orgânicas.
Agora, considere as principais, e dar exemplos.

As substâncias com oxidação -2
compostos de enxofre 2 – é a sua conformação com metais, bem como:
- carbono;
- hidrogénio;
- fósforo;
- silício;
- arsênico;
- boro.
Nesses casos, ele age como um agente oxidante, uma vez que todos estes elementos mais electropositive. Considere especialmente os mais importantes.
- dissulfureto de carbono – CS 2. O líquido transparente com uma agradável éter aroma. É uma substância tóxica e inflamável e explosivo. Usado como um solvente, e para a maioria dos tipos de óleos, gorduras, não-metais, nitrato de prata, resinas e borrachas. Ele também é uma parte importante na produção de seda artificial – viscose. A indústria é sintetizada em grandes quantidades.
- sulfureto de hidrogénio ou sulfureto de hidrogénio – H 2 S. O gás, não tendo qualquer cor e sabor doce. Odor forte, muito desagradável, uma reminiscência de ovo podre. Veneno, deprime o centro respiratório, ligando os iões de cobre. Portanto, quando se trata de envenenamento asfixia e morte. Amplamente utilizado em medicina, de síntese orgânica, a produção de ácido sulfúrico, e matérias-primas como energeticamente favorável.
- sulfuretos de metais são amplamente utilizados na medicina, na produção de ácido sulfúrico, obtendo fósforos de fabricação de tintas, e outros locais. fórmula geral – Me S x y.

Os compostos que têm um grau de oxidação de +4
compostos de enxofre 4 – é de preferência um óxido e os correspondentes sais e ácido. Todos eles são compostos bastante comuns que têm um valor específico na indústria. Eles podem agir como antioxidantes, mas a maioria mostra propriedades redutoras.
compostos de fórmula de enxofre no estado de oxidação 4 seguinte:
- dióxido de enxofre SO2 – óxido;
- ácido – sulfuroso H 2 SO 3;
- Os sais têm a fórmula geral Me x (SO 3) y.
Uma das mais comuns é o dióxido de enxofre, ou anidrido. É uma substância incolor com um odor de fósforos queimados. Em grandes aglomerados formados durante a erupção de vulcões, sua neste ponto é fácil de identificar pelo cheiro.
É dissolvido em água com formação de ácido facilmente decomposição – enxofre. Ele comporta-se como um típico de óxido de ácido formas de sais, que incluem um ião sulfito SO 3 2-. Este anidrido – gás primário, que afeta a poluição atmosfera ambiental. Que afeta a formação de chuva ácida. Industrialmente utilizada no fabrico de ácido sulfúrico.
Os compostos em que enxofre no estado de oxidação 6
Estes incluem principalmente anidrido sulfúrico e ácido sulfúrico com os seus sais:
- sulfatos;
- sulfato de hidrogénio.
Uma vez que o átomo de enxofre aí é na maior estado de oxidação, e as propriedades destes compostos são bastante explicáveis. Eles são oxidantes fortes.
óxido de enxofre (VI) – trióxido de enxofre – representa um liquido volátil incolor. Uma característica – poderosa capacidade dessecante. Ao Ar Livre fuma. Quando dissolvido em água, fornece um dos ácidos minerais fortes – sulfúrico. A solução concentrada é pesado líquido oleoso de cor ligeiramente amarelada. Se o anidrido é dissolvido em ácido sulfúrico, obtém-se um composto particular chamado oleum. Ele é usado na indústria para a produção de ácido.
Entre os sais – Sulfato – é compostos muito importantes, tais como:
- gesso CaSO 4 .2H 2 O;
- barita BaSO4;
- os seus sais;
- sulfato de chumbo e outros.
Eles são usados em construção, síntese química, medicina, fabricação de instrumentos e vidros ópticos e até mesmo a indústria de alimentos.
Hydrogensulfates são amplamente utilizados em metalurgia, em que utilizado como um fundente. E eles ajudam a traduzir muitos dos óxidos complexos em forma de sulfato solúvel que é usado nas indústrias relevantes.
O estudo de enxofre no curso de química da escola
Quando é a melhor é a assimilação de conhecimentos pelos estudantes que é enxofre, quais são as suas propriedades, que é um composto de enxofre? Grade 9 – o melhor período. Este não é o começo, quando as crianças tudo novo e estranho. Esta é a média no estudo da química, quando as bases estabelecidas anteriormente, vai ajudar a compreender completamente o assunto. Portanto, tendo em consideração os dados lançado é a segunda metade da turma. o tópico inteiro é dividido em vários blocos, que significa separadamente lição "compostos de enxofre. Classe 9".
Isto é devido ao seu grande número. Também são considerados separadamente para a produção de ácido sulfúrico na indústria. Em geral, este tópico é dada por uma média de 3 horas.
Mas compostos orgânicos de enxofre são submetidos para o estudo apenas no 10º ano, quando as questões são consideradas orgânica. Também estão afetados e biologia no ensino médio. De facto, o enxofre é uma parte de moléculas orgânicas, tais como:
- tioálcoois (tióis);
- proteínas (estrutura terciária, que é a formação de pontes dissulfureto);
- tioaldeídos;
- tiofen�s;
- tioésteres;
- ácido sulfónico;
- sulfóxidos e outros.
Eles são isolados num grupo separado de compostos organossulfurados. Eles são importantes não só nos processos biológicos dos seres vivos, mas também na indústria. Por exemplo, o ácido sulfónico – a base de muitos medicamentos (aspirina, sulfanilamida ou streptocid).
Além disso, os compostos de enxofre, tais como alguns componente permanente:
- aminoácidos;
- enzimas;
- vitaminas;
- hormônios.