Amônia – é o antípoda e analógica … água?
O cheiro de gás é conhecido por todos – você pode senti-lo imediatamente quando você abre um frasco com amônia. Algo sobre suas propriedades, foi-nos dito na escola. Também é conhecido, contudo, que é um dos produtos principais da indústria química: nomeadamente é mais fácil de transformar o azoto, que não gosta de entrar em reacções químicas. Amoníaco – este é o primeiro ponto de partida para começar a produção de diversos compostos de azoto: vários nitritos e nitratos, explosivos e corantes de anilina, produtos farmacêuticos e plásticos …
fundo
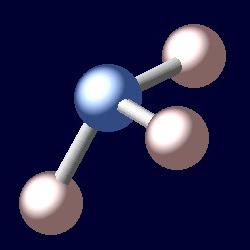 O nome da substância derivada do grego «hals ammoniakos», que se traduz como amônia. molécula de amoníaco é uma certa similaridade de pirâmide, o vértice do qual é um átomo de azoto e na parte inferior – três átomos de hidrogénio. A fórmula deste composto – NH3. Em condições normais, a amônia – é um gás incolor com um odor sufocante afiada. A sua densidade a -33,35 ° C (temperatura de ebulição) igual a 0,681 g / cm 3. Uma substância é fundida a -77,7 ° C. massa molar de amoníaco é de 17 gramas por mole. A pressão de 0,9 MPa, a temperatura ambiente, faz com que o amoníaco a encolher. Recebê-lo na indústria sob pressão através de síntese catalítica de hidrogénio e oxigénio. Líquido amónia – um refrigerante fertilizante altamente concentrada. Com este material deve ter cuidado, porque é tóxico e explosivo.
O nome da substância derivada do grego «hals ammoniakos», que se traduz como amônia. molécula de amoníaco é uma certa similaridade de pirâmide, o vértice do qual é um átomo de azoto e na parte inferior – três átomos de hidrogénio. A fórmula deste composto – NH3. Em condições normais, a amônia – é um gás incolor com um odor sufocante afiada. A sua densidade a -33,35 ° C (temperatura de ebulição) igual a 0,681 g / cm 3. Uma substância é fundida a -77,7 ° C. massa molar de amoníaco é de 17 gramas por mole. A pressão de 0,9 MPa, a temperatura ambiente, faz com que o amoníaco a encolher. Recebê-lo na indústria sob pressão através de síntese catalítica de hidrogénio e oxigénio. Líquido amónia – um refrigerante fertilizante altamente concentrada. Com este material deve ter cuidado, porque é tóxico e explosivo.
fatos interessantes
amônia líquida tem propriedades bastante incomuns. Externamente ele se assemelha a água pura. Como H2O, é perfeitamente dissolve muitos orgânicos e compostos inorgânicos. A maioria dos sais nela se dissociar em iões quando dissolvido. Ao mesmo tempo, a reacção química, ao contrário da água, que ocorre de forma bastante diferente.
|
ZnCl2 |
BaCl 2 |
KCl |
NaCl |
KI |
Ba (NO3) 2 |
Agi |
||
|
Solubilidade a 20 ° C por 100 g de solvente |
amônia |
0 |
0 |
0,04 |
3 |
182 |
97 |
207 |
|
água |
367 |
36 |
34 |
36 |
144 |
9 |
0 |
|
Os dados nesta tabela leva à ideia de que a amônia líquida – um ambiente único para algumas reações de câmbio que não são viáveis em soluções aquosas.  Por exemplo:
Por exemplo:
2AgCl + Ba (NO3) 2 = 2AgNO 3 + BaCl2.
Porque NH3 é forte aceitador de protões, ácido acético, apesar do facto de que é considerado fraco, prodissotsiiruet inteiramente, assim como fazer o ácido forte. De maior interesse são soluções em amônia líquida metais alcalinos. Voltar em 1864, os químicos têm notado que, se você lhes der algum tempo, a amônia se evapora, e no sedimento seria um metal puro. Praticamente o mesmo é verdadeiro com soluções salinas aquosas. A diferença é que os metais alcalinos, mesmo em pequenas quantidades, mas, no entanto, reagiu com amoníaco, formando assim amidas do sal como:
2Na + 2NH 3 = 2NaNH 2 + H 2.
Estes últimos são substâncias muito estáveis, mas em contacto com a água entra em colapso imediato:
NaNH2 + H2O = NH 3 + NaOH.
 Na investigação das propriedades dos químicos de amoníaco líquido ter notado que, quando o metal dissolvido no mesmo, o volume da solução torna-se maior. Além disso, enquanto a sua densidade diminui. Esta é uma outra diferença considerada solvente por água comum. É difícil de acreditar, mas a solução foi concentrada e diluída de qualquer metal alcalino em amoníaco líquido não são misturados um com o outro, não obstante o facto de que o metal em ambos o mesmo! Graças a experimentos constantemente encontrados novos fatos surpreendentes. Assim, verificou-se que líquido congelado em solução de amoníaco de sódio é muito pequena resistência, e, por conseguinte, NH3 pode ser usado para produzir sistema supercondutor. Não surpreendentemente, este gás e suas soluções ainda estão interessados nas mentes de ambos os físicos e químicos.
Na investigação das propriedades dos químicos de amoníaco líquido ter notado que, quando o metal dissolvido no mesmo, o volume da solução torna-se maior. Além disso, enquanto a sua densidade diminui. Esta é uma outra diferença considerada solvente por água comum. É difícil de acreditar, mas a solução foi concentrada e diluída de qualquer metal alcalino em amoníaco líquido não são misturados um com o outro, não obstante o facto de que o metal em ambos o mesmo! Graças a experimentos constantemente encontrados novos fatos surpreendentes. Assim, verificou-se que líquido congelado em solução de amoníaco de sódio é muito pequena resistência, e, por conseguinte, NH3 pode ser usado para produzir sistema supercondutor. Não surpreendentemente, este gás e suas soluções ainda estão interessados nas mentes de ambos os físicos e químicos.