O grau de oxidação do carbono mostra a complexidade de ligações químicas
Cada elemento é capaz de formar uma substância simples estar no estado livre. Neste estado, o movimento dos átomos são os mesmos, eles são simétricos. Nos substâncias complexas a situação é muito mais complicada. As ligações químicas , neste caso, assimétricos, moléculas complexas em compostos complexos formados ligações covalentes.
O que se entende por oxidação
Existem tais compostos em que os electrões são distribuídos de forma desigual quanto possível, isto é, durante a formação de substâncias complexas electrões de valência se mover a partir de um átomo para outro. 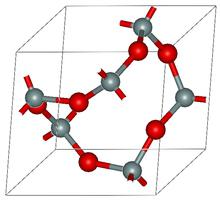 É desta distribuição desigual de substâncias complexas chamados oxidação ou oxidação. Formou-se com a carga de um átomo de uma molécula chamada do grau de oxidação dos elementos. Dependendo da natureza da transferência de electrões a partir de um átomo de distinguir entre um grau negativo ou positivo. Em ambos os casos, a decisão de regresso elemento átomo vários electrões gerado elementos químicos estado de oxidação, respectivamente positivas e negativas (E E + ou -). Por exemplo, uma ficha K significa o átomo de potássio envia um electrão. Em qualquer composto orgânico centro ocupar átomos de carbono. A valência do elemento corresponde a 4-m em qualquer composto, mas em diferentes compostos de carbono do grau de oxidação será diferente, será igual a -2, 2, 4 ±. Esta natureza de diferentes valores de valência e o grau de oxidação é observado em quase todas as articulações.
É desta distribuição desigual de substâncias complexas chamados oxidação ou oxidação. Formou-se com a carga de um átomo de uma molécula chamada do grau de oxidação dos elementos. Dependendo da natureza da transferência de electrões a partir de um átomo de distinguir entre um grau negativo ou positivo. Em ambos os casos, a decisão de regresso elemento átomo vários electrões gerado elementos químicos estado de oxidação, respectivamente positivas e negativas (E E + ou -). Por exemplo, uma ficha K significa o átomo de potássio envia um electrão. Em qualquer composto orgânico centro ocupar átomos de carbono. A valência do elemento corresponde a 4-m em qualquer composto, mas em diferentes compostos de carbono do grau de oxidação será diferente, será igual a -2, 2, 4 ±. Esta natureza de diferentes valores de valência e o grau de oxidação é observado em quase todas as articulações.
Determinação do grau de oxidação
Para determinar o grau de oxidação, é necessário conhecer os postulados fundamentais.  Metais não são capazes de ter um grau de menos, mas existem raras exceções quando o metal forma um composto com o metal. No número de grupo do sistema periódico de átomos corresponde ao maior estado de oxidação possível: carbono, oxigénio, hidrogénio, e qualquer outro membro. átomo electronegativo com o deslocamento para um outro átomo de electrões recebe uma carga de -1, -2, etc dois electrões Esta regra não é aplicável para os mesmos átomos. Por exemplo, a comunicação HH será igual a 0. A comunicação C-H = -1. O grau de oxidação do carbono na posição C-D = + 2. Um e o mesmo valor dos metais são os primeiro e segundo grupos da tabela periódica e fluoro (-1). A este nível de hidrogénio em quase todos os compostos é um hidretos excepto em que é -1. Para os elementos que tem uma extensão não constante, é possível calcular, sabendo que o composto de fórmula. A regra básica, que afirma que a soma dos graus em qualquer molécula é 0.
Metais não são capazes de ter um grau de menos, mas existem raras exceções quando o metal forma um composto com o metal. No número de grupo do sistema periódico de átomos corresponde ao maior estado de oxidação possível: carbono, oxigénio, hidrogénio, e qualquer outro membro. átomo electronegativo com o deslocamento para um outro átomo de electrões recebe uma carga de -1, -2, etc dois electrões Esta regra não é aplicável para os mesmos átomos. Por exemplo, a comunicação HH será igual a 0. A comunicação C-H = -1. O grau de oxidação do carbono na posição C-D = + 2. Um e o mesmo valor dos metais são os primeiro e segundo grupos da tabela periódica e fluoro (-1). A este nível de hidrogénio em quase todos os compostos é um hidretos excepto em que é -1. Para os elementos que tem uma extensão não constante, é possível calcular, sabendo que o composto de fórmula. A regra básica, que afirma que a soma dos graus em qualquer molécula é 0. 
Um exemplo de cálculo do grau de oxidação
Considere-se um cálculo do grau de oxidação do carbono no composto Exemplo CH3Cl. Tome dados de linha de base: o grau de hidrogénio é um, cloro -1 y. Por conveniência, vamos supor x calcular o grau de oxidação do carbono. Em seguida, para CH3Cl ocorrerá equação x + 3 * (+ 1) + (- 1) = 0. Realizando operações aritméticas simples, pode ser determinado que o grau de oxidação do carbono será 2. Desta forma, você pode fazer cálculos para cada elemento no composto complexo.
















